题目内容
5.下列离子方程式书写正确的是( )| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(NO3)3溶液中加人过量的HI溶液2Fe3++2I-═2Fe2++I2 | |
| C. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba-+2BaCO3↓+2HO+CO32- |
分析 A.次氯酸根离子具有强的氧化性,能够氧化亚硫酸根离子;
B.碘离子过量,硝酸根子、三价铁离子都被还原;
C.酸性环境下高锰酸钾氧化亚硝酸根离子生成硝酸根离子;
D.氢氧化钡过量,反应生成碳酸钡、氢氧化钠.
解答 解:A.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++2ClO-+H2O+SO2═CaSO4↓+H++Cl-+HClO,故A错误;
B.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故B错误;
C.NaNO2溶液中加入酸性KMnO4溶液,离子方程式为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,故C正确;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,离子方程式为:HCO3-+Ba-+OH-=BaCO3↓+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,B为易错点,注意硝酸根离子的氧化性,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1mol Fe与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,2.24LCCl4的分子总数为0.1NA | |
| C. | 常温常压下,14g丙烯与环丙烷的混合气体,含碳原子总数为NA | |
| D. | 0.1mol/L CH3COONa溶液中含有的CH3COOH和CH3COO-总数为0.1NA |
13.下列离子方程式书写正确的是( )
| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
20.下列实验操作中错误的是( )
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
10.VmL密度为ρg/mL的某溶液,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为w%,物质的量浓度为cmol/L那么下列关系式正确的是( )
| A. | m=$\frac{{v}_{ρ}w}{1000}$ | B. | c=$\frac{(100{0}_{ρ}w)}{M}$ | C. | W%=[$\frac{cM}{1{0}_{ρ}}$]% | D. | C=$\frac{m}{VM}$ |
17.下列关于热化学方程式书写及对应表达均正确的是( )
| A. | 密闭容器中9.6克硫粉与11.2克铁粉混合加热生成硫化亚铁17.6克时放出19.12 kJ热量,则Fe(S)+S(S)=FeS(S)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸和0.1mol/L的氢氧化钠溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则可知C的燃烧热△H=-110.5 kJ/mol |
14.用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标况下,11.2L CO和N2混合气体中含有的原子数是NA | |
| B. | 100g 98%的浓硫酸中,氧原子总数为4NA | |
| C. | 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
15.二氧化硫的下列性质中,不属于酸性氧化物通性的( )
| A. | SO2+Br2+H2O═H2SO4+2HBr | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 |
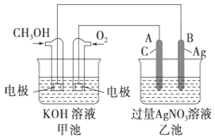 如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.