题目内容
7.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大. 已知A和B原子具有相同的电子层数,且A的最外层电子数是次外层电子数的两倍,C是同周期中原子半径最大的元素,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻. 试根据以上叙述回答:(1)元素名称:E氯
(2)C在元素周期表中的位置第三周期IA族
(3)画出D的原子结构示意图
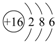 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程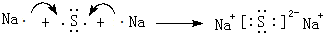
(4)写出AB2与过量氢氧化钠溶液反应的离子方程式CO2+2OH-=CO32-+H2O,写出 C2B2与AB2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的最外层电子数是次外层电子数的两倍,则A有2个电子层,最外层电子数为4,故A为碳元素;C是同周期中原子半径最大的元素,处于IA族,原子序数大于碳,故C为Na;C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素;E与D相邻,则E为Cl,据此解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的最外层电子数是次外层电子数的两倍,则A有2个电子层,最外层电子数为4,故A为碳元素;C是同周期中原子半径最大的元素,处于IA族,原子序数大于碳,故C为Na;C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素;E与D相邻,则E为Cl.
(1)元素E的名称为氯,故答案为:氯;
(2)C为Na,在元素周期表中的位置:第三周期IA族,故答案为:第三周期IA族;
(3)D为硫,原子结构示意图为 ,用电子式表示化合物 Na2S 的形成过程:
,用电子式表示化合物 Na2S 的形成过程: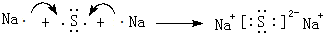 ,
,
故答案为: ;
;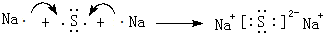 ;
;
(4)CO2与过量氢氧化钠溶液反应的离子方程式:CO2+2OH-=CO32-+H2O,Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:CO2+2OH-=CO32-+H2O;2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重大于化学用语的考查,注意掌握电子式表示化学键或物质的性质过程.

练习册系列答案
相关题目
17.下列有机反应中,不属于取代反应的是( )
| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$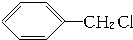 +HCl +HCl | |
| B. | CH2=CH2+Br2→CH2BrCH2Br | |
| C. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| D. | 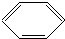 +HO-NO2$→_{△}^{浓硫酸}$ +HO-NO2$→_{△}^{浓硫酸}$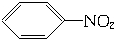 +H2O +H2O |
15.有关乙烯及其相关有机物的结构和性质,下列说法正确的是( )
| A. | 乙烯使酸性高锰酸钾褪色的原理和使溴水褪色的原理相同 | |
| B. | 乙烯不能合成高分子化合物 | |
| C. | 工业制备乙烯通常通过石油的裂解 | |
| D. | 聚乙烯能使溴水褪色 |
2.下列关于0.1mol NH4Fe(SO4)2•24H2O形成的溶液说法正确的是( )
| A. | 该溶液中H+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 该溶液中滴入含0.1molNa0H的稀溶液的离子方程式为:3NH${\;}_{4}^{+}$+Fe3++6OH-═Fe(0H)3↓+3NH3↑+3H2O | |
| C. | 该溶液中加入足量Zn粉的离子方程式为:2Fe3++Zn═Zn2++2Fe2+ | |
| D. | 该溶液中加1L0.2mol/L Ba(0H)2溶液的离子方程式为:NH${\;}_{4}^{+}$+Fe3++2S0${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O |
12.1919年,Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征.下列各对粒子中,空间结构相似的是( )
| A. | CS2与NO2 | B. | SO2与N2O | C. | SO2与O3 | D. | PCl3与BF3 |
19.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 石灰石与稀盐酸混合:CO32-十2H+-═CO2↑+H2O | |
| C. | 铝和烧碱溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Ba2+十SO42-═BaSO4↓ |
16.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 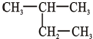 2-乙基丙烷 2-乙基丙烷 | B. |  3-丁醇 3-丁醇 | C. | 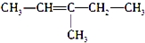 3-甲基-2-戊烯 3-甲基-2-戊烯 | D. | 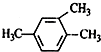 1,3,4-三甲苯 1,3,4-三甲苯 |
17.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物.工业制备镓的流程如下图所示:
下列判断不合理的是( )

下列判断不合理的是( )
| A. | Al、Ga均处于ⅢA族 | B. | Ga2O3可与盐酸反应生成GaCl3 | ||
| C. | Ga(OH)3可与NaOH溶液生成NaGaO2 | D. | 酸性:Al(OH)3>Ga(OH)3 |