题目内容
14.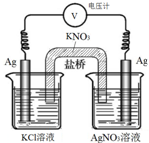 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
分析 A、该装置是原电池;
B、左池银失电子,生成银离子;
C、左边的银失电子生成银离子,与电解质溶液中的氯离子结合生成氯化银,右边电解质溶液中的银离子得电子生成单质银;
D、原电池中的阳离子向正极移动.
解答 解:A、该装置是原电池,是将化学能转化为电能的装置,故A正确;
B、左池银失电子,生成银离子,发生氧化反应,所以左池中的银电极作负极,故B错误;
C、左边的银失电子生成银离子,与电解质溶液中的氯离子结合生成氯化银,右边电解质溶液中的银离子得电子生成单质银,所以总反应为Ag+(aq)+Cl-(aq)?AgCl(s),故C正确;
D、原电池中的阳离子向正极移动,所以盐桥中的K+向右池方向移动,故D正确;
故选B.
点评 本题考查了电化学中原电池的工作原理,明确正负极上发生的电极反应及离子的移动方向即可解答,比较容易.

练习册系列答案
相关题目
4.现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
5.如图是部分短周期元素原子半径与原子序数的关系图.下列说法正确的是( )
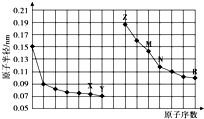

| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
9.有甲(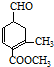 )、乙(
)、乙(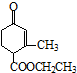 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )
 )、乙(
)、乙( )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |
19.下列说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
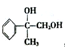 ,G可用作工业增塑剂.回答下列问题:
,G可用作工业增塑剂.回答下列问题: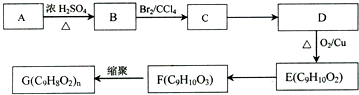
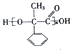 ,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为
,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为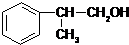 .
.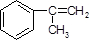 +Br2→
+Br2→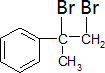 .
.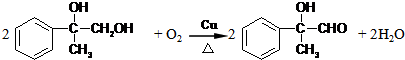 .
. .
.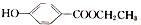 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: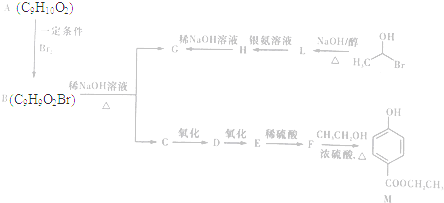
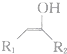 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$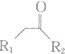 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应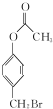 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$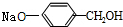 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;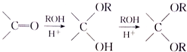 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: