题目内容
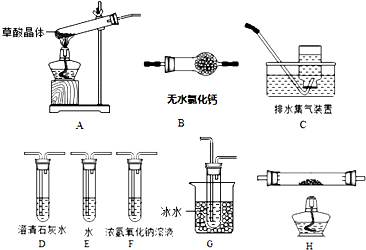
12.下列实验操作中错误的是( )| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
分析 A.过滤时要防止滤纸破损;
B.从蒸馏时温度计的作用的角度考虑;
C.分液时要避免液体重新混合而污染;
D.用玻璃棒搅拌来使液体受热均匀.
解答 解:A.过滤时要防止滤纸破损吗,搅拌能戳坏滤纸,故A错误;
B.蒸馏时,温度计用来测量馏分的温度,应靠近蒸馏烧瓶的支管口处,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可防止液体重新混合而污染,故C正确;
D.在蒸发液体时为了防止液体局部过热而引起液体的飞溅,而用玻璃棒搅拌来使液体受热均匀,故D正确.
故选A.
点评 本题考查常见物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关实验方法、原理和注意事项,难度不大.

练习册系列答案
相关题目
20.取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份.其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
17.下列离子方程式的书写正确的是( )
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
4.现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
1.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
 ;
; ;
;