题目内容
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)
]m(n>2,m≤10)的实验流程如下:

已知:盐基度=n
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是 .取样分析Fe2+浓度,其目的是 .
(2)用pH试纸测定溶液pH的操作方法为 .若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 .(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是 .
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]?[Fe2(OH)n(SO4) 3-n/2]m,则水解反应的化学方程式为 .
(5)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol?L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为 .
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 .
| 3-n |
| 2 |

已知:盐基度=n
| n(OH-) |
| 3n(Fe) |
(1)实验加入硫酸的作用是
(2)用pH试纸测定溶液pH的操作方法为
(3)氧化时控制反应温度为50~60℃的原因是
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]?[Fe2(OH)n(SO4) 3-n/2]m,则水解反应的化学方程式为
(5)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol?L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为
考点:制备实验方案的设计,测定溶液pH的方法,探究物质的组成或测量物质的含量
专题:实验题
分析:(1)Fe2+易水解,加入硫酸可以防止水解.取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量;
(2)pH试纸的操作方法是将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低.
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加.
(4)水解的原理是Fe2+结合水中的OH-;
(5)①酚酞与碱会变红,故达到滴定终点的现象为加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色.
②已知:盐基度=
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算;
(2)pH试纸的操作方法是将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低.
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加.
(4)水解的原理是Fe2+结合水中的OH-;
(5)①酚酞与碱会变红,故达到滴定终点的现象为加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色.
②已知:盐基度=
| n(OH-) |
| 3n(Fe) |
解答:
解:(1)Fe2+易水解,实验加入硫酸的作用是防止亚铁离子水解.取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量.
故答案为:抑制Fe2+水解,确定氧化Fe2+所需H2O2的量;
(2)依据pH试纸的操作方法分析:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低;
故答案为:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
故答案为:温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
(4)水解的原理是Fe2+结合水中的OH-,反应的方程式为:Fe2(SO4)3+nH2O?Fe2(OH)n(SO4) 3-n/2+
H2SO4;
故答案为:Fe2(SO4)3+nH2O?Fe2(OH)n(SO4) 3-n/2+
H2SO4;
(5)①酚酞与碱会变红,故达到滴定终点的现象为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
故答案为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
②已知:盐基度=
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算,w=
×100%=
×100%;
故答案为:
×100%.
故答案为:抑制Fe2+水解,确定氧化Fe2+所需H2O2的量;
(2)依据pH试纸的操作方法分析:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低;
故答案为:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
故答案为:温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
(4)水解的原理是Fe2+结合水中的OH-,反应的方程式为:Fe2(SO4)3+nH2O?Fe2(OH)n(SO4) 3-n/2+
| n |
| 2 |
故答案为:Fe2(SO4)3+nH2O?Fe2(OH)n(SO4) 3-n/2+
| n |
| 2 |
(5)①酚酞与碱会变红,故达到滴定终点的现象为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
故答案为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
②已知:盐基度=
| n(OH-) |
| 3n(Fe) |
| (V0-V)c×10-3 | ||
3×
|
| 56(V0-V)c×10-3 |
| 3mW1 |
故答案为:
| 56(V0-V)c×10-3 |
| 3mW1 |
点评:本题 查了盐类的水解、pH试纸的使用、方程式的书写、物质的量的相关计算,主要是流程分析判断,物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、28g氮气所含有的原子数目为NA |
| B、化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C、标准状况下,22.4L水中含有个水分子NA |
| D、标准状况下,22.4L氯化氢所含的原子数为NA |
等质量的下列气体所含原子数最多的是( )
| A、C2H6 |
| B、CH4 |
| C、CO |
| D、H2 |
常温时,0.01mol?L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s、白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s、灰) Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
①Sn(s、白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s、灰)
 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )| A、△H1>△H2 |
| B、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| C、锡在常温下以灰锡状态存在 |
| D、灰锡转化为白锡的反应是放热反应 |
某课外实验小组设计的下列实验合理的是( )
A、 制备并观察氢氧化亚铁 |
B、 除去二氧化碳中的氯化氢 |
C、 制取干燥、纯净氯气 |
D、 制取少量氧气 |
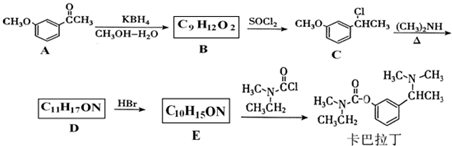
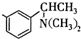 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子. )和丙酮(
)和丙酮( ) 制备化合物
) 制备化合物 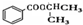 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH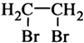

 -R+HX
-R+HX -R
-R -COOH
-COOH