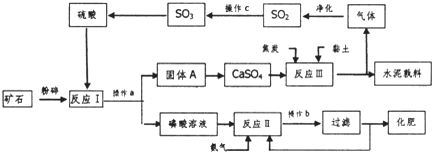
题目内容
已知:①-CH2CH3,-OH,-Cl等取代苯环上的氢后的取代反应容易发生在这类取代基的邻位或对位;而-NO2,-SO3H,-COOH等取代苯环上的氢后的取代反应容易发生在这类取代基的间位.通常把这些取代基称为定位基.
②卤代烃与本可发生如下反应:R-X+
 -R+HX
-R+HX
但若苯环上有间位定位基时,该反应不易发生.
③苯的同系物可发生如下氧化反应: -R
-R
 -COOH
-COOH
根据以上提供的信息,选用苯和乙醇及必要的无机物(自选)合成间一硝基苯甲酸,按合成顺序写出有关化学方程式. .
②卤代烃与本可发生如下反应:R-X+

| AlCl3 |
 -R+HX
-R+HX但若苯环上有间位定位基时,该反应不易发生.
③苯的同系物可发生如下氧化反应:
 -R
-R| KMnO4 |
 -COOH
-COOH根据以上提供的信息,选用苯和乙醇及必要的无机物(自选)合成间一硝基苯甲酸,按合成顺序写出有关化学方程式.
考点:有机物的合成
专题:有机物的化学性质及推断
分析:根据信息②,C2H5OH与NaBr在酸性条件下发生取代反应生成C2H5Br, 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,据此书写各步反应方程式.
,据此书写各步反应方程式.
 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,据此书写各步反应方程式.
,据此书写各步反应方程式.解答:
解:根据信息②,C2H5OH与NaBr在酸性条件下发生取代反应生成C2H5Br, 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,各步反应方程式为:C2H5OH+NaBr
,各步反应方程式为:C2H5OH+NaBr
C2H5Br+NaHSO4+H2O; +C2H5Br
+C2H5Br
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr;
 -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;
故答案为:C2H5OH+NaBr
C2H5Br+NaHSO4+H2O; +C2H5Br
+C2H5Br
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr; -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;
 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,各步反应方程式为:C2H5OH+NaBr
,各步反应方程式为:C2H5OH+NaBr| 硫酸 |
| △ |
 +C2H5Br
+C2H5Br
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr; -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;故答案为:C2H5OH+NaBr
| 硫酸 |
| △ |
 +C2H5Br
+C2H5Br
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr; -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;
点评:本题考查有机物的合成,充分利用给予的反应信息合成物质,考查学生的观察、思维、分析能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,某溶液中由水电离出的出c(H+)=1.0×10-13mol/L则在该溶液中一定不可以大量共存的一组离子是( )
| A、NH4+、NO3-、K+、SO42- |
| B、CO32_、NO3-、HCO3-、Na+ |
| C、Na+、ClO-、AlO2-、NO3- |
| D、MnO4-、K+、Na+、SO42- |
把3molP和2.5molQ置于2L密闭容器中发生如下反应:3P(g)+Q(g)?xM(g)+2N(g) 经5mim反应达平衡时,测知生成1molN,M的平均反应速率为0.1mol/(L.min),下列叙述错误的是( )
| A、P的平均反应速率为0.15 mol/(L.min) |
| B、Q的转化率为25% |
| C、Q的平衡浓度为1mol/L |
| D、x的值是2 |


 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.