题目内容
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
| A、过滤后的溶液中一定没有S2- |
| B、MnS难溶于水,可溶于MnCl2溶液中 |
| C、常温时,CuS、PbS、CdS比MnS更难溶 |
| D、加入MnS后生成CuS的离子方程式是Cu2++S2-=CuS↓ |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,利用CuS、PbS、CdS比MnS更难溶与水的原理转化,据此解答.
解答:
A、难溶不是不溶,只是溶解度小,故A错误;
B、MnS难溶于水也难溶于MnCl2溶液,故B错误;
C、通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,利用CuS、PbS、CdS比MnS更难溶与水的原理转化,故C正确;
D、沉淀转化的离子方程式为:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),故D错误;
故选C.
B、MnS难溶于水也难溶于MnCl2溶液,故B错误;
C、通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,利用CuS、PbS、CdS比MnS更难溶与水的原理转化,故C正确;
D、沉淀转化的离子方程式为:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),故D错误;
故选C.
点评:本题考查了沉淀的转化,注意绝对不溶的物质是没有的,沉淀能够转化,决定于决定于沉淀的溶度积常数的大小,题目难度不大.

练习册系列答案
相关题目
常温时,在pH=13的无色透明溶液中一定能大量共存的一组离子是( )
| A、Na+、SiO32-、NO3-、CO32- |
| B、K+、Cl-、MnO4-、SO42- |
| C、Na+、NO3-、SO42-、HCO3- |
| D、Na+、SO42-、NH4+、Cl- |
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A、氘(
| ||||
B、
| ||||
| C、1H2O与2H2O是同一种物质 | ||||
| D、1H218O与2H216O的相对分子质量相同 |
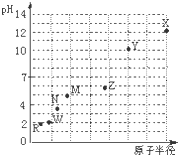 第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A、气态氢化物的稳定性:M>N |
| B、Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C、X和W形成的常见化合物阴阳离子个数比为1:2 |
| D、Z和R组成的化合物是弱电解质 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |


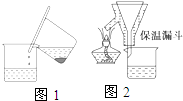 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下: