题目内容
17.某同学用图所示的装置及药品进行比较酸性强弱的实验,下列说法不正确的是( )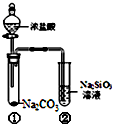
| A. | 向Na2SiO3溶液中直接滴入盐酸溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 一段时间后试管②中有胶冻状物质生成 |
分析 稀盐酸与碳酸钠反应生成二氧化碳气体,证明盐酸的酸性大于碳酸;将生成的二氧化碳气体通入硅酸钠溶液中,会观察到有白色胶状物,反应生成了硅酸胶体,证明了酸性碳酸>硅酸,据此进行解答.
解答 解:A.向Na2SiO3溶液中直接滴入盐酸溶液,会生成白色胶状的硅酸胶体,故A错误;
B.试管①稀盐酸与碳酸钠反应生成二氧化碳气体,离子方程式为CO32-+2H+═CO2↑+H2O,故B错误;
C.由于盐酸具有挥发性,生成的二氧化碳中会混有一定量的氯化氢,将生成的气体通入硅酸钠溶液中生成了硅酸胶体,不能证明酸性碳酸>硅酸,故C错误;
D.试管②二氧化碳气体通入硅酸钠溶液中,生成白色胶状的硅酸胶体,故D正确;
故选ABC.
点评 本题考查了比较酸性相对强弱的方法,题目难度中等,明确实验目的、实验原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
3.利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极,CO(NH2)2中的氮元素显-3价).

下列叙述中正确的是( )

下列叙述中正确的是( )
| A. | 工作时,A极的电极上CO(NH2)2放电生成N2反应为还原反应 | |
| B. | 工作时,B极的电极反应式为2H2O+2e-═2OH-+H2↑ | |
| C. | N型半导体为正极,P型半导体为负极 | |
| D. | 制氢装置溶液中电子流向:从B极流向A极 |
2. 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 甲烧杯中a电极反应式为:4OH--4e-═O2↑+2H2O |
9.下列关于各图象的解释或结论不正确的是( )
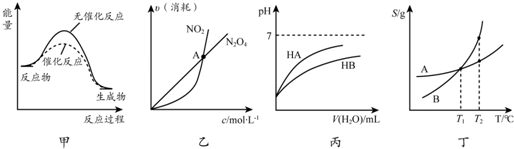

| A. | 由甲可知:使用催化剂不影响反应热 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 | |
| D. | 由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等 |
6.西安市环境保护监测中心2015年12月29日9时发布,西安市空气质量指数:233,属重度污染,监测的主要污染物有PM2.5、NO2、SO2、CO、O3等.下列空气污染物与其主要来源不对应的是
( )
| A | B | C | D | |
| 污染物 | 二氧化硫 | 甲醛 | 氮氧化物 | 悬浮颗粒物 |
| 来源 | 雷电时空气中产生 | 人造家具、用具 | 燃煤、汽车尾气 | 燃煤、施工 |
| A. | A | B. | B | C. | C | D. | D |
7.下列检验离子的方法及结论正确的是( )
| A. | 向某溶液中滴加AgNO3溶液后产生白色沉淀,说明原溶液中含有Cl- | |
| B. | 向某溶液中滴加BaCl2溶液后产生白色沉淀,说明原溶液中含有SO42- | |
| C. | 向某溶液中滴加NaOH溶液并加热,产生气体能使红色石蕊试纸变蓝,说明原溶液中含有NH4+ | |
| D. | 向某溶液中滴加稀硫酸后生成无色无味气体,说明原溶液中含有CO32- |
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置