题目内容
5.某无色透明溶液中可能含有下列离子:Mg2+、Ba2+、Cu2+、H+、CO32-、SO42-,OH-、NO3-、HCO3-中的几种,已知溶液能与铝反应且只放出H2一种气体.回答下列问题:(1)若溶液与铝反应生成Al3+,溶液中一定大量存在的离子有H+、SO42-,可能存在的离子有Mg2+.
(2)若溶液与铝反应生成AlO2-,溶液中一定大量存在的离子有OH-、Ba2+,可能存在的离子有NO3-.
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色.
解答 解:无色透明溶液,说明原溶液中不存在Cu2+;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)当与酸作用时,溶液显酸性,则SO32-、HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,
根据溶液不显电性,一定存在阴离子,即溶液中肯定有SO42-,而Ag+、Ba2+可与SO42-生成沉淀,说明原溶液中也不存在Ag+、Ba2+,
即此时溶液中一定含H+、SO42-,可能存在Mg2+离子,
故答案为:H+、SO42-;Mg2+;
(2)当溶液显碱性时,Mg2+、Cu2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Ba2+,
说明原溶液中的阴离子只能是OH-、NO3-,则原溶液中一定存在的离子为OH-、Ba2+,可能存在NO3-,
故答案为:OH-、Ba2+;NO3-.
点评 本题考查Al的化学性质及离子的共存问题,为高频考点,明确常见离子之间的反应是解答本题的关键,并注意利用溶液为电中性、离子的颜色等来分析解答,题目难度不大.

练习册系列答案
相关题目
12.下列溶液加热蒸干后,能析出原溶质固体的是( )
| A. | NaHCO3 | B. | Fe2(SO4)3 | C. | NH4HCO3 | D. | AlCl3 |
16.下列物质的名称与其化学式相符的是( )
| A. | 液氯(Cl2) | B. | 氯水(Cl2) | C. | 漂白液(NaClO) | D. | 漂白粉[Ca(ClO)2] |
17.某同学用图所示的装置及药品进行比较酸性强弱的实验,下列说法不正确的是( )
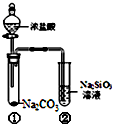

| A. | 向Na2SiO3溶液中直接滴入盐酸溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 一段时间后试管②中有胶冻状物质生成 |
14.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
| A. | 气体A的平衡转化率大于气体B平衡转化率 | |
| B. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数减小 | |
| C. | 物质D的聚集状态一定是气体 | |
| D. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 |
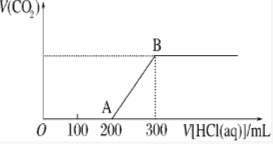 将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )
将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )