题目内容
15.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如图1: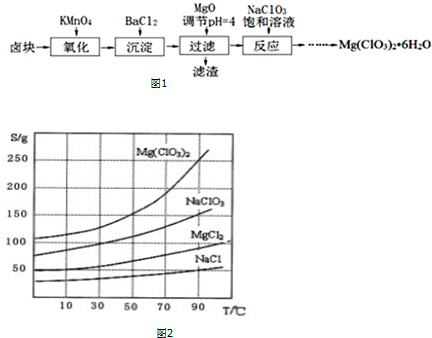
已知:①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
(1)过滤所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯,加MgO后过滤所得滤渣的主要成分为BaSO4和Fe(OH)3
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?取过滤后滤液少许于试管中,滴加适量BaCl2溶液,若不再出现浑浊则SO42-已沉淀完全
(3)加入NaClO3饱和溶液发生反应方程式为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓
再进一步制取Mg(ClO3)2•6H2O的实验步骤依次:①蒸发结晶;②趁热过滤;③冷却结晶;④过滤、洗涤.
(4)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4
溶液,微热.
步骤3:冷却至室温,过量的FeSO4用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
①写出步骤2中发生反应的离子方程式:6Fe2++ClO3++6H+═6Fe3++Cl-+3H2O
②产品中Mg(ClO3)2•6H2O的质量分数为78.3%.
分析 卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入高锰酸钾之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,滤渣有BaSO4和Fe(OH)3,根据溶解度曲线可知,混合溶液中NaCl溶解度最小,再加入NaClO3饱和溶液得到NaCl沉淀与Mg(ClO3)2溶液,经过蒸发浓缩、趁热过滤、冷却结晶、洗涤、干燥得到Mg(ClO3)2•6H2O;
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等;加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去,前一步溶液中还生成硫酸钡沉淀;
(2)硫酸根离子用盐酸酸化的氯化钡检验;
(3)向滤液中加入NaClO3饱和溶液后,发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系,将溶液蒸发浓缩、趁热过滤、冷却结晶、洗涤,得到Mg(ClO3)2•6H2O;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;
②根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量.
解答 解:卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入高锰酸钾之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,滤渣有BaSO4和Fe(OH)3,根据溶解度曲线可知,混合溶液中NaCl溶解度最小,再加入NaClO3饱和溶液得到NaCl沉淀与Mg(ClO3)2溶液,经过蒸发浓缩、趁热过滤、冷却结晶、洗涤、干燥得到Mg(ClO3)2•6H2O;
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯;
加入MgO的作用是调节溶液的pH=4,可以促进铁离子的水解,使杂质Fe3+形成沉淀完全除去,所以加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3,前一步中还生成硫酸钡沉淀,所以滤渣成分为BaSO4和Fe(OH)3;
故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为取过滤后滤液少许于试管中,滴加适量BaCl2溶液,若不再出现浑浊则SO42-已沉淀完全,
故答案为:取过滤后滤液少许于试管中,滴加适量BaCl2溶液,若不再出现浑浊则SO42-已沉淀完全;
(3)向滤液中加入NaClO3饱和溶液后,发生反应:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发浓缩、趁热过滤、冷却结晶、洗涤,就得到Mg(ClO3)2•6H2O,
故答案为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓;趁热过滤;冷却结晶;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%.
故答案为:78.3%.
点评 本题考查物质制备,为高频考点,侧重考查学生阅读、获取信息、利用信息解答问题、综合知识灵活运用、计算能力,明确流程图中发生的反应、各物质成分及其性质是解本题关键,涉及方程式的计算、仪器选取、实验操作、氧化还原反应等知识点,注意正确确定(4)题各个物理量之间的关系式,题目难度中等.

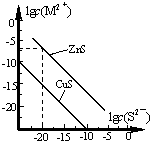 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
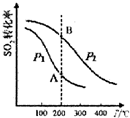 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.