题目内容
10. 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式(1)工业合成氨反应的化学方程式是N2+3H2$?_{高温高压}^{催化剂}$2NH3
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.
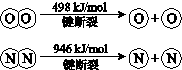
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约72.6kJ;
②H-O 键比H-N键(填“强”或“弱”)强
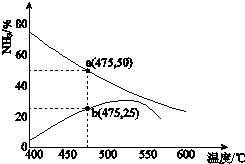
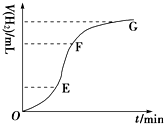
(3)如图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
①图中b点,v(正)> v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=1:4
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是2NH3+3O2═2HNO2+2H2O.
分析 (1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应;
(2)①根据物质的键能变化计算;
②根据键能的差值,判断键的强弱;
(3)①根据反应的方向,判断正逆反应速率的大小;
②根据氨气的体积分数计算n(N2):n(NH3);
(4)水中的氧气氧化氨气生成亚硝酸和水.
解答 解:(1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应,反应的化学方程式为:N2+3H2$?_{高温高压}^{催化剂}$2NH3,
故答案为:N2+3H2$?_{高温高压}^{催化剂}$2NH3;
(2)①根据4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,可知12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,
故答案为:72.6;
②根据(H-O)-(H-N)=72.6kJ/mol,可知H-O 键比H-N键强,
故答案为:强;
(3)①图中b点,氨气的体积分数逐渐增加,可知向正反应方向移动,正反应速率大于逆反应速率;故答案为:>;
②图中a点,设反应的N2为x,
则N2+3H2 ?2NH3
初始物质的量:1 3 0
变化的物质的量:x 3x 2x
平衡时的物质的量:1-x 3-3x 2x
氨气的体积分数为50%时,则$\frac{2x}{1-x+3-3x+2x}$=50%,解之得x=$\frac{2}{3}$,则n(N2):n(NH3)=$\frac{1}{3}$:$\frac{4}{3}$=1:4,
故答案为:1:4;
(4)水中的氧气氧化氨气生成亚硝酸和水,方程式为2NH3+3O2═2HNO2+2H2O,
故答案为:2NH3+3O2═2HNO2+2H2O.
点评 本题考查了工业合成氨、反应热的计算、化学平衡的有关计算等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握三段式在化学平衡计算中的应用.

已知:
①
 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
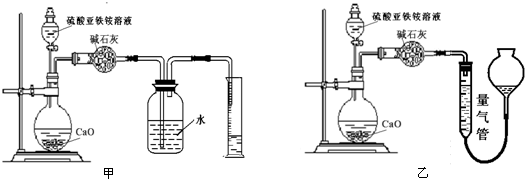
(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
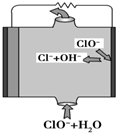 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 放电过程中OH-移向正极 | |
| B. | 电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| D. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
| A. | 空气 | B. | 氨水 | C. | 磁铁矿 | D. | 冰水共存物 |
| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
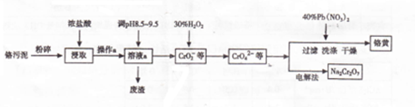
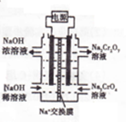
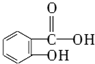 ,俗名水杨酸.
,俗名水杨酸. .
. 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答: