题目内容
8.现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子.(1)写出B、C两种元素的元素名称:B钠,C镁,指出A在周期表中的位置第二周期第VIA族.
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为HF>HCl>H2S(用化学式表示).
(3)写出淡黄色固体E的电子式
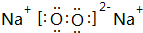 ,其中含有的化学键为离子键和共价键.
,其中含有的化学键为离子键和共价键.(4)用电子式表示C与D元素的原子形成化合物的过程
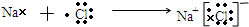 .
. (5)由A、B、D三种元素组成的化合物Y,它的水溶液是一种生活中常见的消毒剂.单质砷(As)可与Y的碱性溶液反应,当消耗1mol还原剂时,消耗2.5mol氧化剂,转移5mol电子.该反应的离子方程式为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O.
分析 A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为O元素;
B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B是Na元素,E为Na2O2;
C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,设C的摩尔质量是M,则$\frac{2.4g}{M}×$2=$\frac{2.24L}{22.4L/mol}×2$,M=24g/mol,;即C为Mg;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl;然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为O元素;
B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B是Na元素,E为Na2O2;
C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,设C的摩尔质量是M,则$\frac{2.4g}{M}×$2=$\frac{2.24L}{22.4L/mol}×2$,M=24g/mol,;即C为Mg;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl;
(1)B、C两种元素的元素名称分别是钠、镁,A原子核外有2个电子层、最外层有6个电子,所以A在周期表中的位置是第二周期第VIA族,故答案为:钠;镁;第二周期第VIA族;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S,所以D的气态氢化物与H2S、HF的稳定性由强到弱为HF>HCl>H2S,故答案为:HF>HCl>H2S;
(3)淡黄色固体E是过氧化钠,过氧化钠的电子式为 ,其中含有的化学键为离子键和共价键,
,其中含有的化学键为离子键和共价键,
故答案为: ;离子键和共价键;
;离子键和共价键;
(4)Na的最外层1个电子,Cl的最外层7个电子,则氯化钠的形成过程为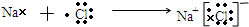 ,
,
故答案为: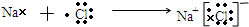 ;
;
(5)由A、B、D三种元素组成的化合物Y,它的水溶液是一种生活中常见的消毒剂,则Y为NaClO,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子,说明生成物中As元素的化合价为+5,Cl元素的化合价为-1,该反应离子方程式为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O,故答案为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O.
点评 本题考查物质结构和性质、物质推断等知识点,侧重考查学生分析判断及综合知识运用能力,正确判断元素、明确物质性质及结构是解本题关键,注意过氧化钠化学式的书写,为易错点.

| A. | 空气 | B. | 氨水 | C. | 磁铁矿 | D. | 冰水共存物 |
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
| A. | NaOH(固体) | B. | KNO3 | C. | HCl | D. | CH3COONa(固体) |
| A. | 半径:Y2->Z->X+>W3+ | B. | 还原性:Y2->Z- | ||
| C. | 氧化性:W3+>X+ | D. | 质子数:c>d>b>a |
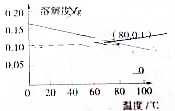
| A. | 熟石灰的溶解是吸热过程 | |
| B. | 温度升高时熟石灰的熔解速率减慢 | |
| C. | 80℃时,熟石灰的Ksp约等于9.8×10-6 | |
| D. | 若硝酸钾中含有少量的熟石灰,可用溶解、过滤的方法进行提纯 |
 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答: 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答: