题目内容
4.下列说法中正确的是( )| A. | 有离子键的化合物中一定没有共价键 | |
| B. | 有共价键的化合物中一定没有离子键 | |
| C. | 物质的熔化过程可能既破坏离子键又破坏共价键 | |
| D. | 物质的熔化过程可能不破坏任何化学键 |
分析 共价化合物只含有共价键,离子化合物一定含有离子键,可能含有共价键,离子化合物熔化时只克服离子键,共价化合物熔化时只克服分子间作用力,以此解答该题.
解答 解:A.有离子键的化合物中可能含有共价键,如NaOH,含有离子键和共价键,故A错误;
B.有些物质含有共价键,也可能含有离子键,如NaOH等,故B错误;
C.离子化合物熔化时只克服离子键,共价化合物熔化时只克服分子间作用力,不克服共价键,故C错误;
D.如为分子晶体,则熔化过程不破坏任何化学键,只破坏分子间作用力,故D正确.
故选D.
点评 本题考查了化学键,明确物质中存在的化学键、物质变化时发生变化的作用力是解本题关键,注意:物质发生化学反应一定有化学键的破坏和形成,有化学键的破坏不一定发生化学反应,如电解质熔融或溶于水就没有化学键的形成,为易错点.

练习册系列答案
相关题目
14.肼(N2H4)是一种无色油状液体,有刺激性气味,有吸湿性.点燃时,迅速而完全燃烧,生成N2和H2O,并放出大量的热.下列有关N2H4的说法不正确的是( )
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |
15.下列说法正确的是( )
| A. | pH=4的醋酸加水稀释过程中,所有离子浓度都降低 | |
| B. | 电解质在某种状态时可能不导电,非电解质自身一定不导电 | |
| C. | 强电解质溶液中一定不存在电离平衡 | |
| D. | 改变条件使电离平衡正向移动,溶液的导电能力一定增强,电离程度一定增大 |
12.向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a≤b时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2═CO32-+HCO3-+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
5.已知R2+核内共有N个中子,R的质量数为A,则m克R2+中含电子的物质的量为( )
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N-2)}{A}$ mol | C. | $\frac{(A-N+2)}{Am}$ mol | D. | $\frac{m(A-N+2)}{A}$ mol |
3.下列叙述中正确的是( )
| A. | 离子化合物中一定不含非极性共价键 | |
| B. | 原子晶体的熔点一定高于其他晶体 | |
| C. | 金属晶体的堆积方式的空间利用率最低的是Po | |
| D. | 构成晶体的粒子一定含有化学键 |
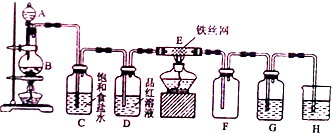
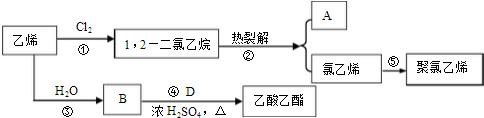
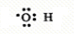 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.