题目内容
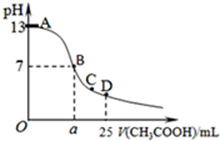 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是( )
| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,二者之间恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),然后根据电荷守恒思想来比较离子浓度大小,注意题中没有告诉温度,pH=7时溶液不一定为中性.
解答:
解:A.在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c(CH3COO-)+c(CH3COOH)=2c(Na+),故A正确;
B.在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故B错误;
C、由于温度不知,无法判断在B点溶液的酸碱性,则无法判断钠离子与醋酸根离子浓度大小,且醋酸根离子、钠离子浓度远远大于氢离子、氢氧根离子浓度,故C错误;
D、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系可能为c (Na+)>c (CH3COO-)>c (OH-)>c (H+),但也可以是氢氧化钠过量,c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故D错误;
故选A.
B.在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故B错误;
C、由于温度不知,无法判断在B点溶液的酸碱性,则无法判断钠离子与醋酸根离子浓度大小,且醋酸根离子、钠离子浓度远远大于氢离子、氢氧根离子浓度,故C错误;
D、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系可能为c (Na+)>c (CH3COO-)>c (OH-)>c (H+),但也可以是氢氧化钠过量,c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故D错误;
故选A.
点评:本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法,特别需要明确本题中没有告诉温度,pH=7时溶液不一定为中性.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
将pH=13的强碱溶液与pH=2的强酸溶液混合后,pH=11,则强碱与强酸的体积比为( )
| A、11:1 | B、9:1 |
| C、1:1 | D、1:9 |
某学习小组用锌片、铜片和稀硫酸进行原电池的相关探究,下列说法正确的是( )
| A、溶液的pH增大 |
| B、溶液中的H+向锌电极定向移动 |
| C、锌电极的反应为2H++2e-=H2↑ |
| D、外电路中,电子由铜电极转移到锌电极 |

 向50mL1mol/L的AlCl3溶液中加入0.2mol/L的NaOH溶液,生成沉淀1.56g,需NaOH溶液多少mL?(根据上题你认为NaOH溶液的体积应该分几种情况)
向50mL1mol/L的AlCl3溶液中加入0.2mol/L的NaOH溶液,生成沉淀1.56g,需NaOH溶液多少mL?(根据上题你认为NaOH溶液的体积应该分几种情况)