题目内容
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,从化学平衡角度考虑,为了提高氨气的产率,可以选择的方法是( )①升高温度 ②增大压强 ③使用催化剂 ④及时分离出NH3.
| A、①③ | B、①② | C、②③ | D、②④ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:该反应是正反应气体体积减小的放热反应,从化学平衡角度考虑,应使平衡向正反应方向移动,有利于提高氨气的产率.
解答:
解:①升高温度平衡向逆反应方向移动,则 氨气的产率降低,故①错误;
②增大压强平衡向正反应方向移动,则氨气的产率增大,故②正确;
③使用催化剂平衡不移动,氨气的产率不变,故③错误;
④及时分离出NH3,可使平衡向正反应方向移动,则氨气的产率增大,故④正确,
故选D.
②增大压强平衡向正反应方向移动,则氨气的产率增大,故②正确;
③使用催化剂平衡不移动,氨气的产率不变,故③错误;
④及时分离出NH3,可使平衡向正反应方向移动,则氨气的产率增大,故④正确,
故选D.
点评:本题考查了影响平衡移动的因素以及平衡转化率的相关知识,注意影响平衡移动的只有温度、浓度和压强三方面因素.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列说法正确的是( )
| A、用惰性电极电解稀硫酸溶液,实质上是电解水,故溶液p H不变 |
| B、浓度相同的NaX与NaY溶液的PH分别为8和9,由此可知HX的酸性比HY的弱 |
| C、pH相同的CH3COOH和NH4Cl溶液中,水的电离程度相同 |
| D、常温下将0.1mol/L的醋酸溶液稀释时,平衡向电离方向移动,但平衡常数值不变 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、将pH相同的盐酸和醋酸稀释相同倍数,醋酸的pH变化大 |
| C、10 mL0.10 mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH都相同HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
PCl5(气)?PCl3(气)+Cl2(气)△H>0 当反应达到平衡时,下列措施:①降温 ②恒容通入惰性气体 ③增加Cl2的浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高PCl5质量分数的是( )
| A、①②④ | B、①③④ |
| C、②③⑥ | D、③⑤⑥ |
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,又知电解质的电离是吸热过程.向1L 0.5mol?L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应.其焓变△H1、△H2、△H3的关系是( )
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H1=△H3>△H2 |
| D、△H1>△H3>△H2 |
下列说法正确的是( )
| A、在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | ||
| B、由“C(石墨)=C(金刚石);△H=+119kJ?mol-1”可知,金刚石比石墨稳定 | ||
| C、在稀溶液中:H+(aq)+OH q)=H2O(l);△H=-57.3l kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ | ||
D、在101KPa时,2g H2生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+
|
下列物质,按熔点由低到高的顺序排列的是( )
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
| A、①③ | B、②④ | C、①② | D、③④ |
某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2).由此推断甲的结构简式为( )
| A、HO-CH2-CH2-OH |
B、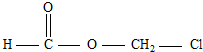 |
C、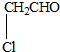 |
D、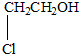 |