题目内容
17.有如下微粒①Mg2+、②N2、③Cu2+、④Cl2、⑤Fe2+、⑥S2-、⑦Fe3+、⑧Al,其中只有氧化性的微粒是①③⑦;(填写编号,下同)只有还原性的微粒是⑥⑧;
既有氧化性又有还原性的微粒是②④⑤.
分析 只有氧化性的物质含元素的化合价处于最高价态,只有还原性的物质含元素的化合价处于最低价态,当元素的化合价处于中间价态时,既具有氧化性又具有还原性,以此来解答.
解答 解:①Mg2+中Mg元素的化合价为最高价,只具有氧化性;
②N2中N元素的化合价为中间价,既有氧化性又有还原性;
③Cu2+中Cu元素的化合价为最高价,只具有氧化性;
④Cl2中Cl元素的化合价为中间价,既有氧化性又有还原性;
⑤Fe2+中N元素的化合价为中间价,既有氧化性又有还原性;
⑥S2-中S元素的化合价为最低价,只具有还原性;
⑦Fe3+中Fe元素的化合价为最高价,只具有氧化性;
⑧Al中Al元素的化合价为最低价,只具有还原性,
其中只有氧化性的微粒是①③⑦;
只有还原性的微粒是⑥⑧;
既有氧化性又有还原性的微粒是②④⑤,
故答案为:①③⑦;⑥⑧;②④⑤.
点评 本题考查氧化还原反应,为高频考点,把握元素的化合价与微粒性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16.Y的原子半径比X的大,X与W同主族,Z 是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、W最高价氧化物对应水化物均能溶解Z的氢氧化物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的强 | |
| D. | 元素X、Y只能形成一种化合物 |
8.与3.2gSO2所含的氧原子数相等的NO2的质量为( )
| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 6.4g |
5.a、b、c、d、e为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c,e2-与a的离子具有相同的电子层结构.下列叙述错误的是( )
| A. | d元素最高价氧化物对应的水化物酸性比c最高价氧化物对应的水化物酸性强 | |
| B. | e与氢气化合比b与氢气化合更容易 | |
| C. | a元素的氢化物是离子化合物 | |
| D. | c在空气中点燃可生成其最高价氧化物 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2气体体积约为22.4 L | |
| C. | 常温常压下,1.6 g CH4含分子数为0.1NA | |
| D. | 常温常压下,3.2g氧气所含氧原子数为0.1NA |
9.下列比较金属性相对强弱的方法或依据正确的是( )
| A. | 根据金属失去电子的多少来判断,失去电子较多的金属性较强 | |
| B. | 用钠置换MgCl2溶液中的Mg2+,来验证钠的金属性强于Mg | |
| C. | Mg不与NaOH溶液反应而Al能与NaOH溶液反应,可说明金属性:Al>Mg | |
| D. | 碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱 |
6.乙酸乙酯在KOH溶液中水解,得到的产物是( )
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醛 | D. | 乙酸 |
7.达菲(Tamiflu)被认为是目前世界上公认的能够治疗禽流感的唯一有效的药物,它是以我国特有药材八角的提取物--莽草酸(shikimicacid)为原料合成的.已知莽草酸和达菲的结构简式如下:下列判断正确的是( )
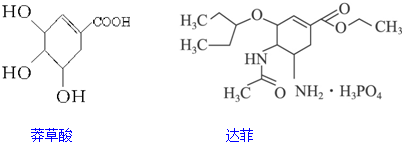

| A. | 它们互为同系物 | |
| B. | 莽草酸和达菲都能使溴的四氯化碳溶液褪色 | |
| C. | 达菲在热的NaOH溶液中能稳定存在 | |
| D. | 1 mol莽草酸可与4 mol NaOH反应 |