题目内容
7.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16.Y的原子半径比X的大,X与W同主族,Z 是地壳中含量最高的金属元素.下列说法正确的是( )| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、W最高价氧化物对应水化物均能溶解Z的氢氧化物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的强 | |
| D. | 元素X、Y只能形成一种化合物 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的金属元素,则Z为Al;W原子序数大于Al,只能处于第三周期,X与W同主族,则X处于第二周期,Y的原子半径比X的大,二者不能同周期,则Y处于第三周期,只能为Na或Mg元素,由四元素原子最外层电子数之和为16,则X、Y、W原子最外层电子数之和为16-3=13,由奇偶性可知,Y只能处于奇数族,故Y为Na,则X、Y原子最外层电子数为(13-1)÷2=6,则X为O元素、W为S元素,以此来解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的金属元素,则Z为Al;W原子序数大于Al,只能处于第三周期,X与W同主族,则X处于第二周期,Y的原子半径比X的大,二者不能同周期,则Y处于第三周期,只能为Na或Mg元素,由四元素原子最外层电子数之和为16,则X、Y、W原子最外层电子数之和为16-3=13,由奇偶性可知,Y只能处于奇数族,故Y为Na,则X、W原子最外层电子数为(13-1)÷2=6,则X为O元素、W为S元素,
A.Y为Na、Z为Al、W为S,同周期自左而右原子半径减小,故原子半径:r(Y)>r(Z)>r(W),故A错误;
B.Y、W最高价氧化物所对应的水化物分别为NaOH、硫酸,Z的氢氧化物为氢氧化铝,氢氧化铝能溶于氢氧化钠、硫酸,故B正确;
C.X为O,W为S,非金属性O>S,故氢化物稳定性X>W,故C错误;
D.元素X、Y可以形成氧化钠、过氧化钠,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.等物质的量的甲烷和氯气混合后,在光照条件下反应,生成物中物质的量最大的是( )
| A. | CH3Cl | B. | CCl4 | C. | CH2Cl2 | D. | HCl |
12.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1.7g羟基所含电子数目为NA | |
| B. | 1L 1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2nNA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
16.下列化学用语正确的是( )
| A. | 乙烯的结构简式为:CH2CH2 | B. | 溴乙烷的分子式为:C2H5Br | ||
| C. | 丙烷分子的比例模型为: | D. | 四氯化碳分子的电子式为: |




 ,H:CH3COOCH=CH2.
,H:CH3COOCH=CH2. +H2O.
+H2O. ,
, .
.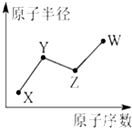 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随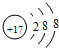 ;
; ;
;