题目内容
8.与3.2gSO2所含的氧原子数相等的NO2的质量为( )| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 6.4g |
分析 先根据n=$\frac{m}{M}$计算出二氧化硫的物质的量,然后计算出二氧化硫中含有氧原子的物质的量,再结合二氧化氮的化学式计算出二氧化氮的物质的量,最后根据m=nM计算出二氧化氮的质量,据此进行计算.
解答 解:3.2g SO2的物质的量为:n(SO2)=$\frac{3.2g}{64g/mol}$=0.05mol,0.05mol二氧化硫分子中含有氧原子的物质的量为:0.05mol×2=0.1mol,
则含有0.1mol氧原子需要NO2的物质的量为:n(NO2)=$\frac{1}{2}$n(O)=$\frac{1}{2}$×0.1mol=0.05mol,
所以与3.2gSO2所含的氧原子数相等的NO2的质量为:46g/mol×0.05mol=2.3g,
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
16.下列化学用语正确的是( )
| A. | 乙烯的结构简式为:CH2CH2 | B. | 溴乙烷的分子式为:C2H5Br | ||
| C. | 丙烷分子的比例模型为: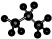 | D. | 四氯化碳分子的电子式为: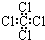 |
3.下列有关银镜反应实验的说法正确的是( )
| A. | 向2%的稀氨水中滴入2%的硝酸银溶液至沉淀恰好溶解,配得银氨溶液 | |
| B. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| C. | 醛类一定能发生银镜反应,能发生银镜反应的一定是醛类 | |
| D. | 可用浓盐酸洗去银镜 |
13.下列物质中不属于有机物的是的是( )
| A. | C2H2 | B. | CH3COOH | C. | SiC | D. | HCHO |
20.取5.8g某种饱和一元醛与足量的银氨溶液混合,加热充分反应后析出21.6g金属银,则该醛为( )
| A. | 甲醛 | B. | 乙醛 | C. | 丙醛 | D. | 丁醛 |
18.C3H8分子中的共价键总数为( )
| A. | 10 | B. | 12 | C. | 8 | D. | 11 |
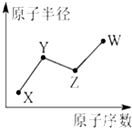 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随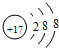 ;
;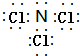 ;
;