题目内容
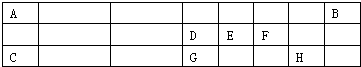
乙醇(俗名酒精)的结构简式为CH3CH2OH,其分子式为C2H6O,相对分子质量为 ,摩尔质量为 .92g乙醇的物质的量为 ,配制成500mL溶液的物质的量浓度为 .
考点:物质的量的相关计算
专题:计算题
分析:相对分子质量等于化学式中各元素原子的相对原子质量的总和,摩尔质量以g/mol为单位,数值上等于其相对分子质量;根据n=
计算92g乙醇的物质的量,根据c=
计算所得溶液的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:乙醇分子式为C2H6O,相对分子质量=12×2+1×6+16=46;
摩尔质量以g/mol为单位,数值上等于其相对分子质量,故乙醇的摩尔质量为46g/mol;
92g乙醇的物质的量=
=2mol;
溶于水,配成500mL 溶液,所得溶液的物质的量浓度=
=4mol/L,
故答案为:46;46g/mol;2mol;4mol/L.
摩尔质量以g/mol为单位,数值上等于其相对分子质量,故乙醇的摩尔质量为46g/mol;
92g乙醇的物质的量=
| 92g |
| 46g/mol |
溶于水,配成500mL 溶液,所得溶液的物质的量浓度=
| 2mol |
| 0.5L |
故答案为:46;46g/mol;2mol;4mol/L.
点评:本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是( )
| A、滴有酚酞的Na2CO3溶液 |
| B、溶有SO2的品红溶液 |
| C、滴有石蕊的AlCl3溶液 |
| D、滴有酚酞的饱和Ca(OH)2溶液 |
19.2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11.2L NO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是( )
| A、0.8 mol |
| B、1.1 mol |
| C、1.2 mol |
| D、2.0 mol |
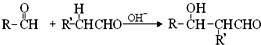 (-R、-R’表示氢原子或烃基)
(-R、-R’表示氢原子或烃基)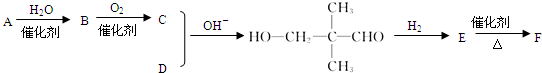
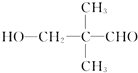 有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为
有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为