题目内容
19.2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11.2L NO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是( )
| A、0.8 mol |
| B、1.1 mol |
| C、1.2 mol |
| D、2.0 mol |
考点:化学方程式的有关计算
专题:计算题
分析:反应中硝酸起氧化剂与酸性作用,起氧化剂作用的硝酸生成NO、NO2,起酸性作用的硝酸生成Cu(NO3)2,根据N原子守恒计算反应消耗HNO3的物质的量.
解答:
解:反应中硝酸起氧化剂与酸性作用,起氧化剂作用的硝酸生成NO、NO2,
根据N原子守恒可知,起氧化剂作用的硝酸的物质的量=n(NO和NO2)=
=0.5mol,
起酸性作用的硝酸生成Cu(NO3)2,则其酸性作用的硝酸的物质的量=2n[Cu(NO3)2]=2n(Cu)=2×
=0.6mol,
根据N原子守恒,反应消耗HNO3的物质的量=0.5mol+0.6mol=1.1mol,
故选B.
根据N原子守恒可知,起氧化剂作用的硝酸的物质的量=n(NO和NO2)=
| 11.2L |
| 22.4L/mol |
起酸性作用的硝酸生成Cu(NO3)2,则其酸性作用的硝酸的物质的量=2n[Cu(NO3)2]=2n(Cu)=2×
| 19.2g |
| 64g/mol |
根据N原子守恒,反应消耗HNO3的物质的量=0.5mol+0.6mol=1.1mol,
故选B.
点评:本题考查化学方程式的计算,注意反应硝酸起的作用不同,从原子守恒的角度解答该题,题目难度中等.

练习册系列答案
相关题目
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是( )
| A、被氧化的元素和被还原的元素的质量之比5:1 |
| B、Cl2既是氧化产物,又是还原产物 |
| C、盐酸既体现酸性,又体现还原性 |
| D、转移5mol电子时,产生67.2L的Cl2 |
下列变化过程中未必吸热的是( )
| A、电解质在熔融状态下电离 |
| B、共价键断裂 |
| C、原子失电子 |
| D、溶解 |
1L丙烷与x L O2混合点燃,丙烷完全反应后,生成混合气体a L(气体体积均在120℃、1,.01×105Pa时测定).将a L混合气体通过足量碱石灰后,测得剩余气体为b L,a-b=6,则x的值是( )
| A、4 | B、4.5 | C、5.5 | D、6 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为.有关咖啡酸的说法中不正确的是( )
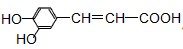
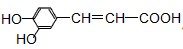
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |
右表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | |||
| Y | Z | R | |
| W |
| A、五种元素可能都是金属元素 |
| B、X的氢化物的沸点一定比Z的氢化物的沸点高 |
| C、R的最高价氧化物对应的水化物一定是强酸 |
| D、五种元素的原子最外层电子数一定都大于2 |