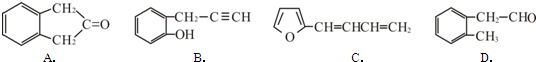题目内容
8. 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)(1)NO的相对分子质量为30.
(2)开始时左右两室分子数:左侧>右侧(填“<”、“>”或“=”).
(3)反应前后NO室压强减小(填“增大”、“不变”或“减小”).
(4)最终容器内密度与原来相同(填“相同”或“不相同”).
分析 (1)一氧化氮的相对分子质量为30;
(2)根据公式N=nNA=$\frac{m}{M}$NA=$\frac{ρV}{M}$NA来计算微粒数;
(3)压强和气体的物质的量成正比;
(4)根据公式$ρ=\frac{m}{V}$来判断密度的变化.
解答 解:(1)一氧化氮的相对分子质量为30,故答案为:30;
(2)由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量相等,但NO和O2的摩尔质量不相等,故其物质的量不相等,开始时左右两室分子数不相同,一氧化氮一侧分子数多,左侧大于右侧,故答案为:>;
(2)由于反应前后NO室的气体物质的量减小,故压强减小,故答案为:减小;
(3)体系的体积和气体的质量均未变化,密度不变,故答案为:相同.
点评 本题考查学生n、M、m、N、ρ等量之间的关系,可以根据公式来定性的判断量的变化情况,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列微粒能将Fe3+还原成Fe2+的是( )
| A. | Cl- | B. | Br- | C. | MnO4- | D. | H2S |
3.抗酸药M可能的组成可以表示为MgaAlb(OH)c(CO3)d(a、b、c、d都不小于0).已知Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,pH=11.4时沉淀完全.实验如下:
(1)本实验需要称量固体,应选择的称量仪器是电子天平(填“托盘天平”或“电子天平”)
(2)M中a、b、c、d之间定量关系式为2a+3b=c+2d.
(3)根据上述数据,确认M的化学式为Mg3Al2(OH)10CO3.
(4)步骤①中反应的离子方程式为10OH-+CO32-+12H+=CO2↑+11H2O.
(5)ω=$\frac{365}{w}$%.
| 步骤 | 实验操作 | 实验现象及数据 |
| ① | 取wgM粉末溶于过量的盐酸 | 产生气体X在标准状况下的体积为224mL,并得到无色溶液 |
| ② | 向步骤①所得的溶液中滴加氨水,调节pH至6,过滤、洗涤、灼烧、称重 | 固体Y的质量为1.020g |
| ③ | 向步骤②所得的滤液中滴加氢氧化钠溶液,调节pH至12,过滤、洗涤、灼烧、称重 | 固体Z的质量为1.200g |
(2)M中a、b、c、d之间定量关系式为2a+3b=c+2d.
(3)根据上述数据,确认M的化学式为Mg3Al2(OH)10CO3.
(4)步骤①中反应的离子方程式为10OH-+CO32-+12H+=CO2↑+11H2O.
(5)ω=$\frac{365}{w}$%.
20.下列各选项所描述的两个量中,前者一定大于后者的是( )
| A. | CH3COONa溶液中CH3COO-和Na+的数目 | |
| B. | 纯水在80℃和25℃时的pH | |
| C. | 相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸中H+的物质的量 | |
| D. | 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
17.下列物质的检验或提纯,其结论或方法正确的是( )
| A. | 某物质中加入BaCl2溶液产生白色沉淀加入稀HNO3后白色沉淀不溶解,说明该溶液中含有Ag+或SO42-中的至少一种 | |
| B. | CO2中混有少量HC1,可用饱和Na2CO3溶液除去 | |
| C. | Cl2中混有少量HCl,可用通入饱和NaCl溶液的方法除去 | |
| D. | N2混有少量NO2,可用水洗法除去 |
18.在反应 2X+5Y═4R+2M中,已知R 和M 的摩尔质量之比为22:9,当2.6克X与Y 完全反应,生成4.4克R,则在此反应中Y 和M 的质量比为( )
| A. | 26:9 | B. | 39:9 | C. | 40:9 | D. | 53:9 |
 )和某合成鞣剂(
)和某合成鞣剂(  )
)

 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基) .
. .
.
 ,写出 X可能的结构简式为
,写出 X可能的结构简式为 .
.

 .
. .
.