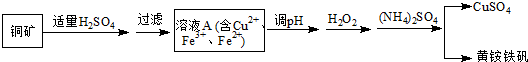题目内容
20.下列各选项所描述的两个量中,前者一定大于后者的是( )| A. | CH3COONa溶液中CH3COO-和Na+的数目 | |
| B. | 纯水在80℃和25℃时的pH | |
| C. | 相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸中H+的物质的量 | |
| D. | 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
分析 A、CH3COO-离子水解;
B、升温促进水的电离,氢离子浓度增大;
C、弱电解质在溶液中浓度越小,电离程度越大;
D、氢氧化钠溶液中抑制水的电离,碳酸钠溶液水解促进水的电离
解答 解:A、CH3COONa溶液中CH3COO-离子水解数目减少,所以CH3COONa溶液中CH3COO-和Na+的数目前者小,故A错误;
B、升温促进水的电离,氢离子浓度增大,纯水在80℃和25℃时的pH,前者小,故B错误;
C、相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸,二者中醋酸的物质的量相同,浓度越小,电离程度越大,溶液中H+的物质的量越大,所以前者大于后者,故C正确;
D、氢氧化钠溶液中抑制水的电离,碳酸钠溶液水解促进水的电离,前者小于后者,故D错误;
故选C.
点评 本题考查了水的电离影响因素分析,盐类水解过程的分析判断,掌握基础是关键,题目难度不大,注意把握温度、酸碱盐溶液对水的电离的影响.

练习册系列答案
相关题目
11.下列物质提纯的方法正确的是( )
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
5.X、Y、Z 3种元素位于周期表中的同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则3种元素的原子序数的大小顺序是( )
| A. | X>Y>Z | B. | Y>Z>X | C. | X>Z>Y | D. | Z>X>Y |
12.下列关于离子方程式的评价正确的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu作电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2-+2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A. | A | B. | B | C. | C | D. | D |
9.苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图1装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见如表所示:

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用如图2流程进行精制.
(3)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸;
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(4)操作2中,收集产品时,控制的温度应在199.6℃;
(5)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%;
(6)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用如图2流程进行精制.
(3)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸;
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(4)操作2中,收集产品时,控制的温度应在199.6℃;
(5)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%;
(6)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
10.下列各组物质,前者逐滴滴加(或逐渐通入)到后者中直至过量,没有出现“先有白色沉淀,后来沉淀又完全消失”现象的是( )
| A. | 盐酸滴入NaAlO2溶液中 | B. | CO2气体通入漂白粉溶液中 | ||
| C. | NaOH溶液滴入AlCl3溶液中 | D. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
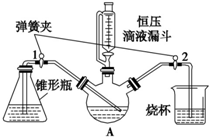 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
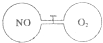 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)