题目内容
14. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:(1)四种元素中电负性最小的是Na(填元素符号),其中C原子的外围电子排布式为3s23p3.
(2)A和B的氢化物所属的晶体类型分别为分子晶体和离子晶体.
(3)B、C均可以与D形成化合物,其中熔点较高的是NaCl(用化学式表示)
(4)A和B可形成1:1型的化合物E,E的电子式为

(5)化合物D2A的立体构型为V形,中心原子的孤电子对数为2,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
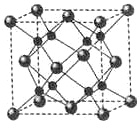
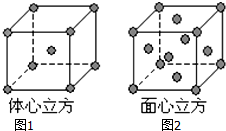
(6)A和B能够形成化合物F,其晶胞结构如图所示,晶胞边长为0.566nm,F 的化学式为Na2O;晶胞中A 原子的配位数为8;晶体F的密度=$\frac{4×62g/mol}{(0.566×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}/mol}$g•cm-3(只列式,不计算)
分析 C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)同主族元素从上到下电负性减小,同周期自左而右电负性增大,四种元素电负性最小的为Na元素;C为P元素,原子核外电子数为15,根据能量最低原理原理书写核外电子排布图;
(2)A、B的氢化物分别为H2O、NaH,前者为分子晶体、后者为离子晶体;
(3)B、C均可以与D形成化合物,分别为NaCl、PCl3或PCl5;
(4)A和B可形成1:1型的化合物E为Na2O2;
(5)化合物D2A为Cl2O,具有水的结构特点,单质氯气与湿润的Na2CO3反应可制备Cl2O,可同时生成碳酸氢钠、氯化钠;
(6)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O,由晶胞结构可知B原子配位数为4,结合化学式可以计算A原子配位数,计算质量和体积,可计算密度.
解答 解:(1)同主族元素从上到下电负性减小,同周期自左而右电负性增大,四种元素电负性最小的为Na元素Na,C为P元素,原子核外电子数为15,根据能量最低原理原理,外围电子排布式为:3s23p3,故答案为:Na;3s23p3;
(2)A的氢化物为H2O,属于分子晶体,B的氢化物为NaH,属于离子晶体,
故答案为:分子晶体; 离子晶体;
(3)B、C均可以与D形成化合物,分别为NaCl、PCl3或PCl5,NaCl为离子化合物,熔点较高,PCl3或PCl5为分子晶体,熔点较低,故答案为:NaCl;
(4)A和B可形成1:1型的化合物E为Na2O2,电子式为 ,故答案为:
,故答案为: ;
;
(5)化合物D2A为Cl2O,具有水的结构特点,O形成2个δ键,含有2个孤电子对,为V形,单质氯气与湿润的Na2CO3反应可制备Cl2O,可同时生成碳酸氢钠、氯化钠,反应的化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,
故答案为:V形;2;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(6)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O,晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,
晶胞的质量为$\frac{4×62g/mol}{6.02×1{0}^{23}/mol}$,
晶胞的体积为(0.566×10-7)cm3,
则晶体F的密度为$\frac{4×62g/mol}{(0.566×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}/mol}$.
故答案为:Na2O;8;$\frac{4×62g/mol}{(0.566×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}/mol}$.
点评 本题是对物质结构与性质的考查,为高考常见题型,涉及涉及核外电子排布、沸点比较、杂化方式与空间构型判断、化学方程式书写、晶胞计算等,侧重考查学生的分析能力、计算能力,难度中等.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ/mol
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 869kJ/mol
下列说法正确的是( )
| A. | 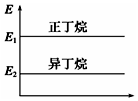 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
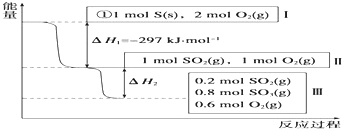
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.
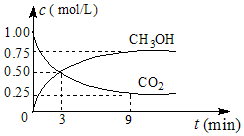
②能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是ABC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
| A. | 用高效催化剂,可使CO2的平衡转化率增大 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的转化率 | |
| D. | 升高温度可使该反应向正反应方向移动 |

 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)