题目内容
10.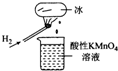 如图所示的实验,发现烧杯中酸性KMn04溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeS04溶液,溶液呈血红色.判断下列说法中不正确的是( )
如图所示的实验,发现烧杯中酸性KMn04溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeS04溶液,溶液呈血红色.判断下列说法中不正确的是( )| A. | 该条件下Hz燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H202 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe2++H2O2+2H+=2Fe3++2H20 |
分析 氢气在空气中燃烧,产物遇冰块冷凝滴入烧杯中.据紫色的KMnO4溶液具有强氧化性,若使其褪色,必定有还原性物质滴入杯中;使FeS04、KSCN混合溶液变红,必定有氧化性物质将Fe2+氧化.从而确定这一冷凝产物既有氧化性又有还原性,根据氧元素的化合价可知该物质可能是HO2、H2O2,以此解答该题.
解答 解:A.烧杯中酸性KMnO4溶液褪色,说明H2燃烧的产物中可能有还原性物质.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色,说明有Fe3+生成,进而说明H2燃烧的产物中可能有氧化性物质,由此说明H2燃烧的产物有还原性和氧化性,故A正确;
B.H2O2具有氧化性与还原性,遇强氧化剂是表现还原性,遇较强的还原剂是表现氧化性,该条件下H2燃烧的产物中可能含有一定量的H2O2,故B正确;
C.KI淀粉溶液中的KI具有还原性,能验证生成物具有氧化性,故C错误;
D.过氧化氢具有氧化性,可在酸性条件下氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H20,故D正确;
故选C.
点评 本题考查化学实验现象的分析、物质的性质知识、氧化性与还原性等,难度不大,根据现象推断物质具有的性质是关键.

练习册系列答案
相关题目
14.某同学按如图所示的装置进行电解实验,下列说法不正确的是( )
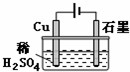

| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主反应方程式为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度几乎不变 |
15.下列有关物质的表达式不正确的是( )
| A. | 醛基的结构简式:-CHO | B. | 甲烷的电子式: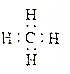 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
2.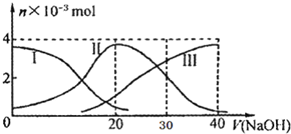 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2 c(OH-) |
19. (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
①25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)>
c(CH3COO-)(填“>”、“<”或“=”).
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”).
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
20.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫的危害.在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为 CO(g)+H2S(g)?COS(g)+H2(g).下列说法能充分说明该反应已经达到化学平衡状态的是( )
| A. | 正、逆反应速率都等于零 | B. | CO、H2S、COS、H2的浓度相等 | ||
| C. | CO、H2S、COS、H2在容器中共存 | D. | CO、H2S、COS、H2的浓度均不再变化 |
 在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.
在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.