题目内容
19.用适当的化学用语来表示下列反应原理(1)氢氧化亚铁放置于空气中,颜色发生改变,有关化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)小苏打溶于水,其电离方程式:NaHCO3=Na++HCO3-;
(3)铁红中铁的化合价为:+3,它与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O;
(4)明矾[KAl(SO4)2•12H2O]能净水是由于其溶于水后生成了(写化学式)Al(OH)3(胶体);
(5)工业上制取漂白液,有关离子方程式并用双线桥标明电子得失:
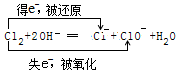 .
.
分析 (1)氢氧化亚铁被氧气氧化成氢氧化铁;
(2)NaHCO3是弱酸的酸式盐,电离出钠离子和碳酸氢根离子,注意碳酸氢根离子不能拆开;
(3)铁红为氧化铁,根据在化合物中正负化合价代数和为零,结合铁红的化学式进行解答即可;氧化铁和酸发反应生成铁离子和水;
(4)明矾溶于水后生成具有吸附作用的胶状物氢氧化铝;
(5)工业上制取漂白液,Cl2+2NaOH═NaCl+NaClO+H2O中,只有Cl元素的化合价变化,Cl元素的化合价由0升高为+1价,由0降低为-1价,据此用双线桥标明电子得失.
解答 解:(1)氢氧化亚铁在空气中会迅速变灰绿色、最后变为红褐色,氢氧化亚铁与氧气和水发生反应生成氢氧化铁,反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)碳酸为弱酸,NaHCO3是弱酸的酸式盐,电离方程式为:NaHCO3=Na++HCO3-,
故答案为:NaHCO3=Na++HCO3-;
(3)铁红为氧化铁,化学式为Fe2O3,氧显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x×2+(-2)×3=0,则x=+3价,氧化铁和盐酸反应生成氯化铁和水,离子反应为:Fe2O3+6H+=2Fe3++3H20,
故答案为:+3;Fe2O3+6H+=2Fe3++3H2O;
(4)明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,反应的离子方程式为:Al3++3H2O=Al(OH)3(胶体)+3H+;
故答案为:Al(OH)3(胶体);
(5)工业上制取漂白液,Cl2+2NaOH═NaCl+NaClO+H2O中,只有Cl元素的化合价变化,Cl元素的化合价由0升高为+1价,由0降低为-1价,该反应中Cl既被氧化也被还原,该反应中转移电子为e-,则双线桥标得失电子数方法为 ;
;
故答案为: .
.
点评 本题考查元素化合物知识,掌握铁、钠、铝、氯及其化合物的性质是解答关键,题目难度不大.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案| 二甲苯一溴水代物熔点(℃) | 234 | 206 | 213.8 | 204 | 211.5 | 205 |
| 对应二甲苯熔点(℃) | 13.3 | -47.9 | -25.2 | -47.9 | -25.2 | -47.9 |
| A. | 熔点234℃的一溴二甲苯是一溴对二甲苯 | |
| B. | 熔点204℃的一溴二甲苯是一溴邻二甲苯 | |
| C. | 熔点-47.9℃的二甲苯是对二甲苯 | |
| D. | 熔点205℃的一溴二甲苯是一溴间二甲苯 |
| A. | C2H4和C3H6的混合物的质量为a g,所含碳氢键数目为aNA/7 | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
| A. | KBr | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgSO4 |
| A. | 常温常压下,22.4LH2O中含有分子数为NA | |
| B. | 常温常压下,28gCO和N2的混合物所含的质子数为14NA | |
| C. | 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| D. | 常温下,1mol/L Na2CO3溶液中阴离子总数等于NA |
| A. | 氧化铁通常用作红色油漆和涂料 | |
| B. | 用铝制餐具长期存放碱性食物 | |
| C. | 过氧化钠可以用作潜水艇里氧气的来源 | |
| D. | 硅可用于制作电脑芯片 |
| A. | 28% | B. | 56% | C. | 72% | D. | 80% |
| A. | 原子半径:A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物的稳定性 | |
| C. | A的最高价氧化物与B的单质可以发生置换反应 | |
| D. | C的氧化物的熔点比A的氧化物熔点低 |
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 铁粉与硫粉需要加热才能发生的反应,则此反应是吸热反应 | |
| D. | 1mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷燃烧热 |