题目内容
11.现有20.0g某铁矿石样品(主要成分为Fe2O3和FeO).粉碎后加入足量盐酸(假设杂质不与盐酸反应),充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤,将所得沉淀在空气中蒸干并灼烧,冷却后称得固体质量为16.0g,则该铁矿石样品中铁元素的质量分数为( )| A. | 28% | B. | 56% | C. | 72% | D. | 80% |
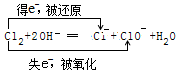
分析 发生Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3、2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,沉淀灼烧最后得到的固体为Fe2O3,利用化学式中Fe元素的质量分数计算Fe2O3中Fe元素的质量,根据质量数可知,16gFe2O3中Fe元素的质量等于样品中铁元素的质量,再根据质量分数的计算样品中铁的质量分数.
解答 解:沉淀灼烧最后得到的固体16.0g为Fe2O3,故16gFe2O3中Fe元素的质量为16g×$\frac{112}{160}$=11.2g,
由元素守恒可知,样品中Fe元素的质量为11.2g,样品中Fe元素的质量分数为$\frac{11.2g}{20g}$×100%=56%,
故选B.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、灼烧后固体成分为解答的关键,侧重分析与计算能力的考查,注意元素守恒的应用,题目难度不大.

练习册系列答案
相关题目
1.分子式为C5H12O且含有2个甲基(-CH3)的有机化合物共有(不考虑立体异构)( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
2.下列有关化学实验的叙述正确的是( )
| A. | 用已知浓度的盐酸滴定未知浓度的氨水选用酚酞做指示剂 | |
| B. | 用待测液润洗滴定用的锥形瓶 | |
| C. | Na2CO3溶液保存在带橡胶塞的试剂瓶中 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
6.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br- | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-、Al(OH)3 |
16.下列变化中,加入铁粉不可能实现的是( )
| A. | Ag+→Ag | B. | Fe3+→Fe2+ | C. | H+→H2 | D. | Fe(OH)2→Fe(OH)3 |
3.下列说法正确的是( )
| A. | 电解精炼粗铜时,粗铜应作阴极 | |
| B. | 氯碱工业的阳极区得到的产品是H2和NaOH | |
| C. | 将金属与直流电源的负极相连的方法叫做外加电流的阴极保护法 | |
| D. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快 |
20.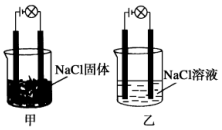 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
( )
 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
| A. | NaCl溶液是电解质 | |
| B. | 在通电的条件下,NaCl在水中电离出大量的离子而导电 | |
| C. | NaCl固体中无阴阳离子,因此不能导电 | |
| D. | 同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强 |
1. 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )| A. | Na2SO3溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | 当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-) | |
| C. | M 点时溶液中:c(SO32-)>c(HSO3-) | |
| D. | 向N点的吸收液中加水可使溶液的pH由6.2升高到7.4 |
 .
.