题目内容
7.将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是( )| A. | KBr | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgSO4 |
分析 Mg(OH)2难溶于水,KBr、K2SO4、Na2CO3都是可溶性的强电解质,氯离子、硫酸根离子不水解,结合化学式计算氯离子、硫酸根的物质的量,Na2CO3溶液中由于CO32-+H2O?HCO3-+OH-,阴离子数目会增加,但水解比较微弱.
解答 解:对于A和D,由于KBr和MgSO4溶于水并完全电离,所以n(Cl-)=n(SO42-)=0.1mol l(水电离出的OH-可忽略);对于B,B中的Mg(OH)2在水中难溶,故溶液中n(OH-)<0.1mol;对于C,在Na2CO3溶液中,由于CO32-+H2O?HCO3-+OH-,阴离子数目会增加,即阴离子物质的量大于0.1mol.由上分析,Na2CO3溶液中的阴离子数目最多,故C正确.
故选:C.
点评 本题考查盐类水解,为高频考点,把握物质的溶解性、电离、水解为解答的关键,侧重分析与应用能力的考查,注意阴离子种类的判断,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
17.下列烃中,一氯代物的同分异构体的数目最多的是( )
| A. |  | B. |  | C. |  | D. |  |
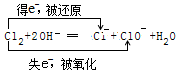
18.Cl2与热的NaOH溶液发生反应:3Cl2+6NaOH═5NaCl+NaClO3+3H2O.关于该反应的说法,正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1 mol NaClO3转移6 mol电子 | |
| C. | 还原产物是NaClO3,氧化产物是NaCl | |
| D. | 被氧化的氯原子与被还原的氯原子个数比为1:5 |
2.下列有关化学实验的叙述正确的是( )
| A. | 用已知浓度的盐酸滴定未知浓度的氨水选用酚酞做指示剂 | |
| B. | 用待测液润洗滴定用的锥形瓶 | |
| C. | Na2CO3溶液保存在带橡胶塞的试剂瓶中 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
16.下列变化中,加入铁粉不可能实现的是( )
| A. | Ag+→Ag | B. | Fe3+→Fe2+ | C. | H+→H2 | D. | Fe(OH)2→Fe(OH)3 |
17.在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol•L-1、0.15mol•L-1,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
| A. | 0.15 mol•L-1 | B. | 0.225 mol•L-1 | C. | 0.30 mol•L-1 | D. | 0.45 mol•L-1 |
 .
.