题目内容
8.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,且A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )| A. | 原子半径:A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物的稳定性 | |
| C. | A的最高价氧化物与B的单质可以发生置换反应 | |
| D. | C的氧化物的熔点比A的氧化物熔点低 |
分析 短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,且A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,则A、C同主族,A的次外层电子数应为2,则B的最外层电子数为2,设A的最外层电子数为x,则x+2+x=10,解得x=4,可知A为C,C为Si,B为Mg,以此来解答.
解答 解:由上述分析可知,A为C,B为Mg,C为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:A<C<B,故A错误;
B.非金属性A>C,则A的氢化物的稳定性大于C的氢化物的稳定性,故B正确;
C.二氧化碳与Mg发生置换反应生成MgO和C,为置换反应,故C正确;
D.二氧化硅为原子晶体,二氧化碳为分子晶体,则C的氧化物的熔点比A的氧化物熔点高,故D错误;
故选AD.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
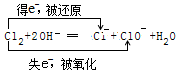
18.Cl2与热的NaOH溶液发生反应:3Cl2+6NaOH═5NaCl+NaClO3+3H2O.关于该反应的说法,正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1 mol NaClO3转移6 mol电子 | |
| C. | 还原产物是NaClO3,氧化产物是NaCl | |
| D. | 被氧化的氯原子与被还原的氯原子个数比为1:5 |
16.下列变化中,加入铁粉不可能实现的是( )
| A. | Ag+→Ag | B. | Fe3+→Fe2+ | C. | H+→H2 | D. | Fe(OH)2→Fe(OH)3 |
3.下列说法正确的是( )
| A. | 电解精炼粗铜时,粗铜应作阴极 | |
| B. | 氯碱工业的阳极区得到的产品是H2和NaOH | |
| C. | 将金属与直流电源的负极相连的方法叫做外加电流的阴极保护法 | |
| D. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快 |
13.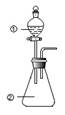 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ① | ② | 现象 |
| A | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| B | 氯化铁溶液 | 铁氰化钾溶液 | 产生蓝色沉淀 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| D | 偏铝酸钠 | 稀盐酸 | 立即产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
20.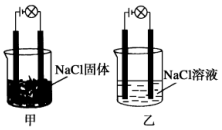 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
( )
 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
| A. | NaCl溶液是电解质 | |
| B. | 在通电的条件下,NaCl在水中电离出大量的离子而导电 | |
| C. | NaCl固体中无阴阳离子,因此不能导电 | |
| D. | 同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强 |
17.在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol•L-1、0.15mol•L-1,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
| A. | 0.15 mol•L-1 | B. | 0.225 mol•L-1 | C. | 0.30 mol•L-1 | D. | 0.45 mol•L-1 |
18.下列各组溶液中离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、NO3- |
 .
.