题目内容
14.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,22.4LH2O中含有分子数为NA | |
| B. | 常温常压下,28gCO和N2的混合物所含的质子数为14NA | |
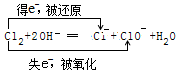
| C. | 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| D. | 常温下,1mol/L Na2CO3溶液中阴离子总数等于NA |
分析 A.气体摩尔体积使用对象为气体;
B.CO和N2的摩尔质量都为28g/mol,含有质子数相等1个分子都含有14个质子;
C.氯气与铁反应,氯气做氧化剂,氯气与氢氧化钠反应,氯气既是氧化剂又是还原剂;
D.溶液体积未知.
解答 解:A.常温常压下,水是液体,不能使用气体摩尔体积,故A错误;
B.CO和N2的摩尔质量都是28g/mol,故28gCO和N2的混合物的物质的量为$\frac{28g}{28g/mol}$=1mol,含有的质子数14NA,故B正确;
C.1molCl2分别与足量的铁反应,氯气做氧化剂全部被还原,转移2mol电子,氯气与氢氧化钠反应为歧化反应,消耗1mol氯气,转移1mol电子,故C错误;
D.依据n=CV可知溶液体积未知,无法计算微粒个数,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析判断,注意气体摩尔体积的条件应用分析,氧化还原反应电子转移,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.分子式为C4HCl9的有机物共有(不含立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
5.设NA表示阿伏伽德罗常数的数值,下列说法错误的是( )
| A. | 常温常压下,1 mol氦气含有的核外电子数为2NA | |
| B. | 1.7gCH5+离子中含有的电子总数为NA | |
| C. | lmolC10H22分子中共价键总数为31 NA | |
| D. | lmolNO2与足量水反应时共转移2NA个电子 |
2.下列有关化学实验的叙述正确的是( )
| A. | 用已知浓度的盐酸滴定未知浓度的氨水选用酚酞做指示剂 | |
| B. | 用待测液润洗滴定用的锥形瓶 | |
| C. | Na2CO3溶液保存在带橡胶塞的试剂瓶中 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
9.下列各组离子在给出条件下一定能大量共存的是( )
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 水电离的c(H+)=1.0×10-13mol•L-1的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
6.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br- | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-、Al(OH)3 |
3.下列说法正确的是( )
| A. | 电解精炼粗铜时,粗铜应作阴极 | |
| B. | 氯碱工业的阳极区得到的产品是H2和NaOH | |
| C. | 将金属与直流电源的负极相连的方法叫做外加电流的阴极保护法 | |
| D. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快 |
4.制取水处理剂C1O2(其部分性质如下表所示)的方法之一是利用草酸(H2C2O4)与氯酸钾反应,反应的化学方程式为2KC1O3+aH2C2O4+H2SO4=2C1O2↑+K2SO4+2CO2↑+bH2O.下列有关该反应的说法不正确的是( )
| 熔点/℃ | 沸点/℃ | 水溶性 |
| -59.5 | 11.0 | 极易溶解 |
| A. | 化学方程式中的a=l,b=2 | |
| B. | 草酸起到还原剂的作用 | |
| C. | KC1O3中只有Cl元素被还原 | |
| D. | 在标准状况下生成5.6L C1O2,转移0.2mol电子 |
 .
.