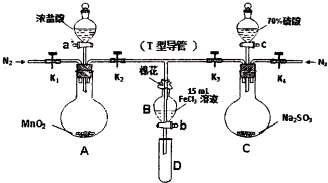
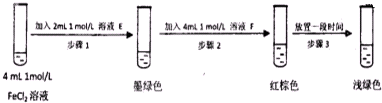
题目内容
把2.5molA和2.5molB混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)?x C(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol?L-1?s-1,同时生成1molD,试计算:
(1)达到平衡状态时B的转化率 .
(2)x的值为 .
(3)保持该反应条件不变,8s时容器内气体的物质的量为 .
(1)达到平衡状态时B的转化率
(2)x的值为
(3)保持该反应条件不变,8s时容器内气体的物质的量为
考点:化学平衡的计算
专题:化学平衡专题
分析:根据三段式解题法,求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量.
平衡时,生成的C的物质的量为 0.2mol/(L﹒s)×5s×2L=2mol,
3A(气)+B(气)?XC(气)+2D(气),
开始(mol):2.5 2.5 0 0
变化(mol):1.5 0.5 0.5X 1
平衡(mol):1.5 2 2 1
X=4,
根据相关计算公式计算相关物理量;
(1)转化率=
×100%;
(2)依据上述计算得到x的值;
(3)5s反应达平衡,8s时容器内气体的物质的量和5s时的平衡气体物质的量相同.
平衡时,生成的C的物质的量为 0.2mol/(L﹒s)×5s×2L=2mol,
3A(气)+B(气)?XC(气)+2D(气),
开始(mol):2.5 2.5 0 0
变化(mol):1.5 0.5 0.5X 1
平衡(mol):1.5 2 2 1
X=4,
根据相关计算公式计算相关物理量;
(1)转化率=
| 消耗量 |
| 起始量 |
(2)依据上述计算得到x的值;
(3)5s反应达平衡,8s时容器内气体的物质的量和5s时的平衡气体物质的量相同.
解答:
解:平衡时,生成的C的物质的量为 0.2mol/(L﹒s)×5s×2L=2mol,
3A(气)+B(气)?XC(气)+2D(气),
开始(mol):2.5 2.5 0 0
变化(mol):1.5 0.5 0.5X 1
平衡(mol):1.5 2 2 1
X=4,
(1)达到平衡状态时B的转化率=
×100%=
×100%=20%;
故答案为:20%;
(2)依据上述减少得到x的值为4;
故答案为:4;
(3)5s反应达平衡,8s时容器内气体的物质的量和5s时的平衡气体物质的量相同,所以容器内气体的物质的量=1.5mol+2mol+2mol+1mol=6.5mol;
故答案为:6.5mol.
3A(气)+B(气)?XC(气)+2D(气),
开始(mol):2.5 2.5 0 0
变化(mol):1.5 0.5 0.5X 1
平衡(mol):1.5 2 2 1
X=4,
(1)达到平衡状态时B的转化率=
| 消耗量 |
| 起始量 |
| 0.5mol |
| 2.5mol |
故答案为:20%;
(2)依据上述减少得到x的值为4;
故答案为:4;
(3)5s反应达平衡,8s时容器内气体的物质的量和5s时的平衡气体物质的量相同,所以容器内气体的物质的量=1.5mol+2mol+2mol+1mol=6.5mol;
故答案为:6.5mol.
点评:本题考查了化学平衡的计算应用,主要是转化率、平衡浓度,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列关于溶液和胶体的叙述,正确的是( )
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、电泳现象可证明胶体带电 |
| C、可用丁达尔效应来区分溶液和胶体 |
| D、刚含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )
| A、反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min) |
| B、反应开始至2分钟时,A的转化率为10% |
| C、若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 |
D、若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图 |
根据表中数据,下列判断正确的是( )
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
在5L密闭容器中,1molA和3molB在一定条件下反应:A(g)+mB(g)?2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是( )
| A、m值等于3 |
| B、平衡时,体系中c(A):c(B):c(C)=4:9:8 |
| C、A的转化率为40% |
| D、用B表示该反应的平均反应速率为0.08mol?L-1?min-1 |