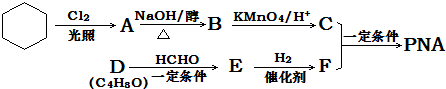
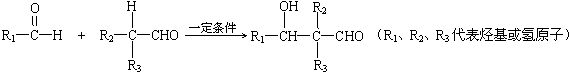
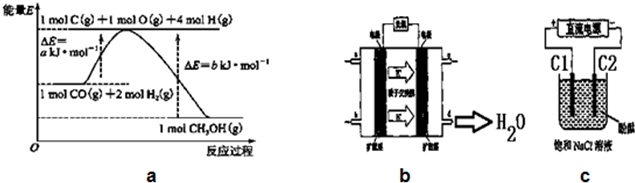
题目内容
在5L密闭容器中,1molA和3molB在一定条件下反应:A(g)+mB(g)?2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是( )
| A、m值等于3 |
| B、平衡时,体系中c(A):c(B):c(C)=4:9:8 |
| C、A的转化率为40% |
| D、用B表示该反应的平均反应速率为0.08mol?L-1?min-1 |
考点:化学平衡的计算
专题:化学平衡专题
分析:利用三段式分析,
A(气)+mB(气)?2C(气)
起始(mol) 1 3 0
转化(mol) 0.4 0.4m 0.8
平衡(mol) 0.6 3-0.4m 0.8
由题意可知,0.6+3-0.4m+0.8=3.2,所以m=3,据此答题.
A(气)+mB(气)?2C(气)
起始(mol) 1 3 0
转化(mol) 0.4 0.4m 0.8
平衡(mol) 0.6 3-0.4m 0.8
由题意可知,0.6+3-0.4m+0.8=3.2,所以m=3,据此答题.
解答:
解:根据三段式计算,
A(气)+mB(气)?2C(气)
起始(mol) 1 3 0
转化(mol) 0.4 0.4m 0.8
平衡(mol) 0.6 3-0.4m 0.8
由题意可知,0.6+3-0.4m+0.8=3.2,所以m=3,
A、由以上分析得m=3,故A正确;
B、平衡时,物质的量比A:B:C=0.6:(3-1.2):0.8=3:9:4,故B错误;
C、A的转化率为
×100%=40%,故C正确;
D、B的平均反应速率为
mol?L-1?min-1=0.08mol?L-1?min-1,故D正确;
故选B.
A(气)+mB(气)?2C(气)
起始(mol) 1 3 0
转化(mol) 0.4 0.4m 0.8
平衡(mol) 0.6 3-0.4m 0.8
由题意可知,0.6+3-0.4m+0.8=3.2,所以m=3,
A、由以上分析得m=3,故A正确;
B、平衡时,物质的量比A:B:C=0.6:(3-1.2):0.8=3:9:4,故B错误;
C、A的转化率为
| 0.4 |
| 1 |
D、B的平均反应速率为
| ||
| 3 |
故选B.
点评:本题主要考查计量数的确定、反应速率的计算、转化率的计算等知识,难度不大,解题时注意运用三段式分析.

练习册系列答案
相关题目
1998年7月8日,全国科学技术名称审定委员会公布了101-109号元素的中文定名.而早在1996年2月,德国达姆施塔特重离子研究所就合成出当时最重的人造元素,它是由
Zn撞入一个
Pb的原子核,并立即释放一个中子而产生的一种新元素的原子.该元素的原子序数是( )
70 30 |
208 82 |
| A、111 | B、112 |
| C、113 | D、114 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表
已知表中t1>t2,下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时间容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升至800℃时,若上述反应平衡常数为0.64,则正反应为吸热反应 |
下列有关沉淀溶解平衡的说法中,正确的是( )
| A、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B、可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| C、在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| D、25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI溶液,有黄色沉淀生成 |
氢气与碘蒸气按1:1体积比混和,使其在一定条件下反应,达到平衡时,碘化氢气体体积占反混合气体体积的50%,则反应混合气体中氢气所占的体积百分比是( )
| A、50% | B、33.3% |
| C、25% | D、20% |
铁镍蓄电池又称爱迪生电池,其充、放电按下式进行:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |