题目内容
根据表中数据,下列判断正确的是( )
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
考点:难溶电解质的溶解平衡及沉淀转化的本质,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、在等浓度的NaF、NaH2PO4混合溶液中,根据电荷守恒可知c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-)+2c(HPO42-)+3c(PO43-);
B、H3PO4的K1=7.5×10-3,大于HF的K=3.6×10-4,运用强制弱;
C、对应的酸的电离平衡常数越小,酸根离子对应的盐水解程度越大碱性越强;
D、酸根离子对应的酸越弱,对应酸结合氢离子的能力越强.
B、H3PO4的K1=7.5×10-3,大于HF的K=3.6×10-4,运用强制弱;
C、对应的酸的电离平衡常数越小,酸根离子对应的盐水解程度越大碱性越强;
D、酸根离子对应的酸越弱,对应酸结合氢离子的能力越强.
解答:
解:A、在等浓度的NaF、NaH2PO4混合溶液中,根据电荷守恒可知c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-)+2c(HPO42-)+3c(PO43-),故A错误;
B、H3PO4的K1=7.5×10-3,大于HFK=3.6×10-4,运用强制弱,所以能发生:H3PO4+F-=H2PO4-+HF,故B正确;
C、对应的酸的电离平衡常数越小,酸根离子对应的盐水解程度越大碱性越强,H3PO4的K1=7.5×10-3,H2PO4-的K2=6.2×10-8,HF的K=3.6×10-4,所以同温同浓度时,溶液的pH:Na2HPO4>NaF>NaH2PO4,故C错误;
D、酸根离子对应的酸越弱,对应酸结合氢离子的能力越强,所以结合H+的能力:PO43->HPO42->F-,故D错误;
故选B.
B、H3PO4的K1=7.5×10-3,大于HFK=3.6×10-4,运用强制弱,所以能发生:H3PO4+F-=H2PO4-+HF,故B正确;
C、对应的酸的电离平衡常数越小,酸根离子对应的盐水解程度越大碱性越强,H3PO4的K1=7.5×10-3,H2PO4-的K2=6.2×10-8,HF的K=3.6×10-4,所以同温同浓度时,溶液的pH:Na2HPO4>NaF>NaH2PO4,故C错误;
D、酸根离子对应的酸越弱,对应酸结合氢离子的能力越强,所以结合H+的能力:PO43->HPO42->F-,故D错误;
故选B.
点评:本题考查弱电解质的电离,电荷守恒,离子浓度的大小,以及结合氢离子的能力,综合性强,难度较大.

练习册系列答案
相关题目
胶体区别于其它分散系的本质是( )
| A、胶体粒子直径在1-100nm之间 |
| B、胶体粒子有颜色 |
| C、胶体是一种混合物 |
| D、光束通过胶体时有丁达尔效应 |
下列叙述正确的是( )
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
氢气与碘蒸气按1:1体积比混和,使其在一定条件下反应,达到平衡时,碘化氢气体体积占反混合气体体积的50%,则反应混合气体中氢气所占的体积百分比是( )
| A、50% | B、33.3% |
| C、25% | D、20% |
某温度下,向 2.0L 恒容密闭容器中充入 1.0 molA 和 1.0 molB,发生反应 A(g)+B(g)?C(g)△H<0,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是.
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/moL | 1 | 0.8 | 0.75 | 0.70 | 0.70 |
| A、反应在前 5s 的平均速率v (A)=0.04mol?L-1 |
| B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,反应再次达到平衡前v (正)>v (逆) |
| C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,反应再次达到平衡时 c(C)小于 0.075 mol?L-1 |
| D、相同温度下,若起始时向容器中充入 2.0 mol C,达到平衡时,C 的转化率大于 70% |
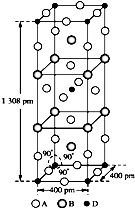 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: