题目内容
13.某同学用如图所示装置图制取并收集干燥的氯气.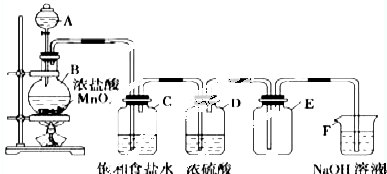
回答下列问题:
(1)装置C的作用是除去氯气中的氯化氢,装置D的作用是干燥氯气.
(2)装置F的作用是尾气处理防止氯气污染空气.
(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl 的 物质的量为0.2mol.
(4)写出圆底烧瓶中发生的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)F处发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,因为浓盐酸具有挥发性,所以制取的氯气中含有氯化氢、水蒸气,依据氯气、氯化氢在饱和氯化钠溶液溶解度不同,利用氯化钠饱和溶液吸收氯气中的氯化氢,浓硫酸具有吸水性,能够干燥氯气,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收过量的氯气,据此解答.
解答 解:(1)因为浓盐酸具有挥发性,所以制取的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度很小,氯化氢易溶于水,所以利用氯化钠饱和溶液吸收氯气中的氯化氢,浓硫酸具有吸水性,所以装置D作用:干燥氯气;
故答案为:除去氯气中的氯化氢;干燥氯气;
(2)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应,可以用盛有氢氧化钠溶液的F吸收过量的氯气;
故答案为:尾气处理防止氯气污染空气;
(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,
故答案为:0.2mol;
(4)圆底烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,离子方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)F中氢氧化钠与氯气反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查氯气的实验室制备,为高频考点,明确氯气制备原理和氯气的性质是解题关键,题目难度不大.

 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | Cl2、Br2、I2的熔沸点依次升高 | |
| B. | 因为自然界中没有游离态的P元素,所以非金属性P>N | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,一定无K+ | |
| D. | 已知FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变程度相同 |
| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 质谱 | D. | 银镜反应 |
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
| A. | 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸 | |
| B. | 达到滴定终点后,静置1~2min再读数,主要是为了防止管壁有液体残留引起误差 | |
| C. | 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用普通玻璃棒进行搅拌,准确读取反应前后温度、取2~3次的实验平均值 | |
| D. | 某溶液可能含有SO42-和Cl-,可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银,来检验其中的Cl- |
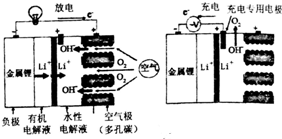
| A. | 充电时,锂离子向阴极移动 | |
| B. | 充电时阴极电极反应式为:Li++e-═Li | |
| C. | 放电时正极电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 负极区的有机电解液可以换成水性电解液 |
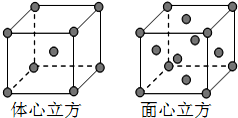 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: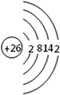 .
.