题目内容
13.下列说法正确的是( )| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| B. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O c(NH4+)由大到小的顺序是:②>①>③ | |
| C. | 0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合(忽略混合时体积变化):c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
分析 A.NaHSO3是强碱弱酸酸式盐,HSO3-电离程度大于其水解程度导致溶液呈酸性,但其电离和水解程度都较小;
B.①②都是强电解质,完全电离,氢离子抑制铵根离子水解,③是弱电解质,部分电离;
C.任何电解质溶液中都侧重电荷守恒,根据电荷守恒判断;
D.NaOH是强碱溶液,pH相同时其浓度最小;pH相同的钠盐,弱酸根离子水解程度越大其浓度越小.
解答 解:A.NaHSO3是强碱弱酸酸式盐,HSO3-电离程度大于其水解程度导致溶液呈酸性,但其电离和水解程度都较小,所以离子浓度大小顺序是c(HSO3-)>c(SO32-)>c(H2SO3),故A正确;
B.①②都是强电解质,完全电离,氢离子抑制铵根离子水解,③是弱电解质,部分电离,所以c(NH4+)由大到小的顺序是:①>②>③,故B错误;
C.任何电解质溶液中都侧重电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.1 mol•L-1,故C正确;
D.NaOH是强碱溶液,pH相同时其浓度最小;pH相同的钠盐,弱酸根离子水解程度越大其浓度越小,碳酸根离子水解程度大于醋酸根离子,所以pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故D错误;
故选AC.
点评 本题考查离子浓度大小比较,为高频考点,涉及弱电解质的电离和盐类水解,明确弱电解质电离及盐类水解特点是解本题关键,注意电荷守恒的灵活运用,易错选项是C,溶液混合后体积增大一倍导致浓度降为原来的一半,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
3.硼有两种天然同位素${\;}_5^{10}$B和${\;}_5^{11}$B,硼元素的近似相对原子质量为10.80,则对硼元素中${\;}_5^{10}$B的物质的量分数的判断正确的是( )
| A. | 10% | B. | 20% | C. | 50% | D. | 80% |
4.对充有氖气的霓虹灯管通电,灯管发出红色光,产生这一现象的主要原因( )
| A. | 在电流的作用下,氖原子与构成灯管的物质发生反应 | |
| B. | 电子由激发态向基态跃迁时以光的形式释放能量 | |
| C. | 氖原子获得电子后转变成发出红光的物质 | |
| D. | 电子由基态向激发态跃迁时吸收除红光以外的光线 |
1.有主族元素A、B、C、D、E,相对位置如图所示.C的原子序数是D的两倍.
(1)E位于元素周期表中第四周期,第VA族,该周期共有18种元素
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程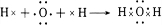 .
.
| D | ||
| A | B | C |
| E |
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程
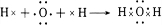 .
.
8.关于元素周期表的说法,下列正确的是( )
| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
18.甲、乙两种非金属元素,能说明甲比乙的非金属性强的是( )
①甲单质比乙单质容易与氢气化合
②甲元素的单质能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强
④与某金属反应时,甲比乙得电子数多
⑤甲的单质熔沸点比乙的单质低.
①甲单质比乙单质容易与氢气化合
②甲元素的单质能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强
④与某金属反应时,甲比乙得电子数多
⑤甲的单质熔沸点比乙的单质低.
| A. | 只有③④ | B. | 只有①②⑤ | C. | 只有①②③ | D. | ①②③④⑤ |
5.关于如图所示装置的叙述,正确的是( )


| A. | 铜片上没有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电流从锌片经导线流向铜 | D. | 氢离子在铜片表面被还原 |
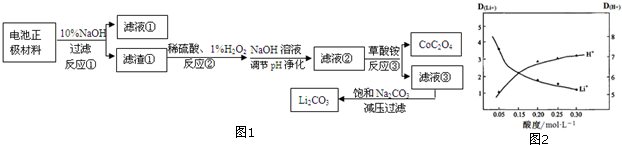
3.以废旧锂电池正极材料(含LiCoO2、Al、Cu、Fe等)为原料通过图1方法获得CoC2O4和Li2CO3.
已知:ⅰ.LiCoO2是不溶于水的固体
ⅱ.25℃时,部分电解质的Ksp或Ka
回答下列问题:
(1)滤液①的主要成分是Na[Al(OH)4](填化学式,下同),滤液③中的阴离子除OH-外主要还含有C2O42-、SO42-.
(2)反应②中H2O2改用盐酸代替,不妥的原因是盐酸反应后会产生有毒气体Cl2同时盐酸不能氧化二价亚铁;写出反应②中钴元素化合物与H2O2反应的化学方程式2LiCoO2+3H2SO4+H2O2=2CoSO4+O2↑+Li2SO4+4H2O.
(3)减压过滤就是抽滤,抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是过滤速度快.
(4)若滤液②中c(Co2+)=3.0mol•L-1,加入等体积的(NH4)2C2O4后,钴的沉降率达到99.9%,计算滤液③中 c(C2O42-)=4.2×10-5mol•L-1.
(5)采用有机物萃取Li+的方法可提取锂.其中有机物中加入一定量Fe3+以提高萃取率,D为离子在有机层与水层的分配比.图2是其他条件不变,水相的酸度与D(H+)、D(Li+)的变化图象.解释萃取液酸度控制在0.05mol•L-1的原因可抑制萃取剂中Fe3+水解,同时此酸度时,Li+的萃取率较高.(写2点)
(6)在反应③中用草酸铵作沉淀剂,25℃时,(NH4)2C2O4溶液pH<7(填“=”或“>”或“<”).

已知:ⅰ.LiCoO2是不溶于水的固体
ⅱ.25℃时,部分电解质的Ksp或Ka
| 弱电解质 | CoC2O4 | Fe(OH)3 | NH3•H2O | H2C2O4 |
| 平衡常数 | Ksp=6.3×10-8 | Ksp=2.79×10-39 | Ka=1.7×10-5 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
(1)滤液①的主要成分是Na[Al(OH)4](填化学式,下同),滤液③中的阴离子除OH-外主要还含有C2O42-、SO42-.
(2)反应②中H2O2改用盐酸代替,不妥的原因是盐酸反应后会产生有毒气体Cl2同时盐酸不能氧化二价亚铁;写出反应②中钴元素化合物与H2O2反应的化学方程式2LiCoO2+3H2SO4+H2O2=2CoSO4+O2↑+Li2SO4+4H2O.
(3)减压过滤就是抽滤,抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是过滤速度快.
(4)若滤液②中c(Co2+)=3.0mol•L-1,加入等体积的(NH4)2C2O4后,钴的沉降率达到99.9%,计算滤液③中 c(C2O42-)=4.2×10-5mol•L-1.
(5)采用有机物萃取Li+的方法可提取锂.其中有机物中加入一定量Fe3+以提高萃取率,D为离子在有机层与水层的分配比.图2是其他条件不变,水相的酸度与D(H+)、D(Li+)的变化图象.解释萃取液酸度控制在0.05mol•L-1的原因可抑制萃取剂中Fe3+水解,同时此酸度时,Li+的萃取率较高.(写2点)
(6)在反应③中用草酸铵作沉淀剂,25℃时,(NH4)2C2O4溶液pH<7(填“=”或“>”或“<”).