题目内容
16.某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E生成淡黄色沉淀 |
(1)实验目的:探究同一周期主族元素性质的递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液等.仪器:①烧杯,②试管,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
分析 (1)根据实验方案可知实验目的,①③④⑤是同一实验目的,②可说明另一实验目的;
(2)根据实验条件和实验药品的性质结合实验操作判断所需仪器;
(3)根据实验现象来判断实验方案及发生的化学反应;
(4)根据实验现象比较金属性、非金属性的强弱,分析实验的结论;
解答 解:(1)由实验方案①③④⑤可验证金属的活泼性,②可验证非金属的活泼性,即实验目的为证明同周期元素金属性,非金属性递变规律(或证明第三周期元素金属性,非金属性性递变规律或证明Na、Mg、Al金属性强弱及S、Cl非金属性强弱,
故答案为:探究同一周期主族元素性质的递变规律;
(2)钠与滴有酚酞试液的冷水反应,一般应在烧杯中进行;做镁带、铝条与2mol/L的盐酸反应,一般要在试管中进行;向新制得的Na2S溶液中滴加少量新制的氯水,需要胶头滴管;
故答案为:烧杯;试管;胶头滴管;
(3)由A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色可知,该现象对应方案③钠与滴有酚酞试液的冷水反应,离子反应为:2Na+2H2O=2Na++2OH-+H2↑;
由B.有气体产生,溶液变成浅红色可知,该现象对应的方案为①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞,离子反应为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+H2↑;
由C.反应不十分剧烈,产生无色气体,该现象对应的方案为⑤将铝条投入稀盐酸中,离子反应为:2Al+6H+=2Al3++3H2↑;
由D.剧烈反应,产生大量无色气体可知,该现象对应的方案为④将镁条投入稀盐酸中,离子反应为:Mg+2H+=Mg2++H2↑;
由E.生成淡黄色沉淀可知,该现象对应的方案为②向新制得的Na2S溶液中滴加少量新制的氯水,发生的离子反应为:S2-+Cl2=2Cl-+S↓;
故答案为:
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | B | Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+H2↑ |
| 2 | E | S2-+Cl2=2Cl-+S↓ |
| 3 | A | 2Na+2H2O=2Na++2OH-+H2↑ |
| 4 | C | Mg+2H+=Mg2++H2↑ |
| 5 | D | 2Al+6H+=2Al3++3H2↑ |
点评 本题是综合考查了同周期元素性质的递变规律的探究,题目难度不大,培养了学生分析和解决问题的能力,注意物质的性质以及元素周期律的递变规律的运用.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| X | Y | ||
| Z | W | Q |
| A. | W得电子能力比Q强 | |
| B. | Z的氧化物能与水直接化合生成对应的酸 | |
| C. | 钠与Y可能形成的两种常见化合物阴阳离子个数比均为1:2 | |
| D. | X有多种同素异形体,而Y不存在同素异形体 |
| A. | C | B. | CO | C. | CH4 | D. | C2H5OH |
| A. | NH4Cl的电子式: | |
| B. | N2的电子式: | |
| C. | S原子的结构示意图: | |
| D. | 质子数为26、中子数为30的铁原子:${\;}_{26}^{56}$Fe |
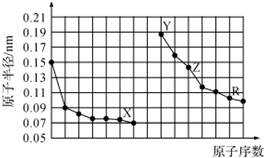
| A. | X、Y分别是O、Na元素 | |
| B. | R的单质与足量X2反应生成RX3 | |
| C. | Z的氧化物熔点很高,是较好的耐火材料 | |
| D. | 电解熔融的Z的氧化物可以得到单质Z |
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42- ) | B. | c(HC2O4-)+c(C2O42-)=0.01 mol•L-1 | ||
| C. | c(C2O42- )<c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ) |
 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )| A. | 属于芳香族化合物 | B. | 属于卤代烃 | ||
| C. | 含有官能团酯基 | D. | 在一定条件下可以发生加成反应 |
| A. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| B. | 氯水、氨水、浓硝酸都要存放在棕色瓶里 | |
| C. | 铵态氮肥不能与草木灰混合使用,但可以暴晒在太阳底下 | |
| D. | SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| A. | 烷烃分子中,所有的化学键都是单键 | |
| B. | 烷烃在光照条件下都能与氯气发生取代反应 | |
| C. | 烷烃的分子通式为CnH2n+2,符合通式的烃不一定是烷烃 | |
| D. | 随着碳原子数的增加,烷烃的熔沸点逐渐升高 |