题目内容
8.某小组研究影响反应速率的因素..(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
分析 (1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,据此分析C的数值;
②据图可知,是要通过测量在相同的时间内收集到的氢气体积的大小来测量反应速率,据此分析反应开始后的操作;
③通过图象来分析单位时间内氢气的体积的变化可知醋酸、盐酸与镁条反应的速率的变化情况;
(2)①Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀;
②当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究Na2S2O3溶液浓度不同对反应速率的影响,则加入的Na2S2O3溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短.
解答 解:(1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,故醋酸和盐酸的浓度应相同,故C也应为1.0mol/L,
故答案为:1.0;
②据图可知,是要通过测量在相同的时间段内收集到的氢气体积的大小来测量反应速率,故在反应开始后,应每隔1min记录一次生成H2的体积,
故答案为:每隔1min记录一次生成H2的体积;
③通过图象分析可知,单位时间内醋酸与镁条反应生成氢气的体积变化很小,即醋酸与镁条的反应速率变化不大;而盐酸与镁条的反应一开始很快,一段时间后,单位时间内生成的氢气的体积明显变小,即反应速率明显减小,
故答案为:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小;
(2)醋酸的电离程度是已电离的电解质分子数占原来总分子数的百分比,故要求醋酸的电离程度,故应测出醋酸溶液的浓度和溶液中H+的浓度.
①Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,其反应的离子方程式为:S2O32-+2H+═S↓+H2O+SO2↑;
故答案为:温度;
②当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①③的反应条件可知,实验①③可探究温度对反应速率的影响;实验①②中的Na2S2O3溶液的加入体积不同,故要探究Na2S2O3溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同,故甲应为V(蒸馏水)/mL,a的值为5.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是出现浑浊的时间/min;
故答案为:温度;V(蒸馏水)/mL;5.0;出现浑浊的时间/min.
点评 本题考查了影响反应速率的因素的探究,应注意的是当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,综合性较强,难度中等,侧重于考查学生的实验探究能力和对基础知识的应用能力.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |

| A. | 二者属于同系物 | B. | 二者都属于芳香烃 | ||
| C. | 二者互为同分异构体 | D. | B可发生加成反应 |
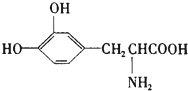 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下下列关于L-多巴胺的叙述不正确的是( )
| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
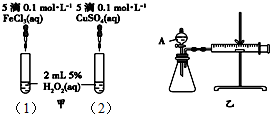 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100 mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol•L-1.
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
②铝无论与1.5mol/L硫酸还是3.0mol/L硫酸进行反应,与盐酸相比都无明显现象,根据以上铝与稀盐酸和稀硫酸反应差异,有人做出了一种假设或者猜想
假设或猜想一:Cl-能促进金属铝与H+的反应
假设或猜想二:SO42-对H+与金属铝的反应起阻碍作用
请将上述猜想补充完整,并验证.除上述试剂外,还有下列试剂可以选择:单质Mg、Na2SO4固体、NaCl固体、硝酸将上述没有明显反应的溶液中加入少量的NaCl固体,如果产生气泡,说明假设一成立
(2)试用简单的一种实验证明,在醋酸溶液中存在着:CH3COOH?H++CH3COO-的电离平衡.限制选试剂和用品:PH试纸、PH=2的醋酸溶液、醋酸钠固体、蒸馏水,仪器任选.写出简要操作、现象.(结论已经给你写好)将pH=2的溶液稀释100后,再测定其pH,若pH小于4,说明醋酸溶液中存在电离平衡说明醋酸溶液中存在电离平衡.
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |