题目内容
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
分析 A、氢氧化钠由1个钠离子和1个氢氧根构成;
B、醋酸是弱酸,在溶液中不能完全电离;
C、标况下四氯化碳为液态;
D、反应:ClO3-+5Cl-+6H+=3Cl2+3H2O转移5mol电子,生成3mol氯气.
解答 解:A、氢氧化钠由1个钠离子和1个氢氧根构成,故0.1mol氢氧化钠中含0.1NA个阴离子,故A正确;
B、醋酸是弱酸,在溶液中不能完全电离,故溶液中的氢离子的个数小于0.05NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、反应:ClO3-+5Cl-+6H+=3Cl2+3H2O转移5mol电子,生成3mol氯气,故当生成1mol氯气时转移$\frac{5}{3}$NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.某小组研究影响反应速率的因素..
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
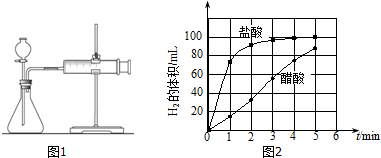
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
①完成上述反应原理的离子反应方程式S2O32-+2H+═S↓+H2O+SO2↑
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
9.在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③空间伸展方向 ④自旋状态.
①能层 ②能级 ③空间伸展方向 ④自旋状态.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
6.下列说法正确的是( )
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中NH4+、Al3+、NO3-、Cl-可以共存 | |
| B. | 氧化镁可以用作耐火材料 | |
| C. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| D. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
3.下列有关叙述正确的是( )
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
8.分子式为C9H12的芳香烃的苯环上的一氯代物的数目为( )
| A. | 8种 | B. | 16种 | C. | 22种 | D. | 24种 |