题目内容
13.某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下.| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?否.
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极还是正极负极,理由是在NaOH溶液中,活动性Al>Mg.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中铝作正极的原因:Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:另一个电极材料的活动性和电解质溶液的性质.
分析 (1)金属与酸构成的原电池中,活泼金属作负极;
(2)实验3中Al为负极,石墨为正极,电池反应为2Al+6HCl═2AlCl3+3H2↑;
(3)实验4中发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极;
(4)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,所以电流计指针偏向铝;
(5)在原电池中,正负极的判断与金属的活泼性有关,与电解质溶液的性质也有关,总之失电子的极是负极,得电子的极是正极.
解答 解:(1)金属与酸构成的原电池中,活泼金属作负极,则实验1中Mg的活泼性大于Al,所以Al作正极,而实验2中Al的活泼性大于Cu,所以Al作负极,
故答案为:否;
(2)①实验3中Al为负极,电极反应为2Al-6e-═2Al3+,故答案为:负;2Al-6e-═2Al3+;
②石墨为正极,其电极反应为6H++6e-═3H2↑,故答案为:正;6H++6e-═3H2↑;
③电池总反应式:2Al+6HCl═2AlCl3+3H2↑,故答案为:2Al+6HCl═2AlCl3+3H2↑;
(3)实验4中Mg不与NaOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,在NaOH溶液中,活动性Al>Mg,则Al为负极,负极反应为Al-3e-+4OH-═AlO2-+2H2O,
故答案为:负极;在NaOH溶液中,活动性Al>Mg;Al-3e-+4OH-═AlO2-+2H2O;
(4)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝,
故答案为:Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极;
(5)在原电池中金属铝作正极还是作负极,一定要看自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极,与另一个电极材料的活动性,电解质溶液的性质有关,
故答案为:另一个电极材料的活动性和电解质溶液的性质.
点评 本题考查探究原电池原理及设计,为高频考点,把握发生的原电池反应及正负极的判断是解答本题的关键,注意利用氧化还原反应中电子的得失来分析正负极,注意知识点的灵活运用和变通,题目难度不大.

| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
| A. | CH3CH2CH2CH2CH3和 互为同分异构体 互为同分异构体 | |
| B. | 干冰和冰为同一种物质 | |
| C. | CH3CH3和CH3CH2CH3互为同系物 | |
| D. | 12C和14C互为同位素 |
| A. | 0.1mol铜粉在0.05mol氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 常温常压下,22.4L氙气中含有NA个氙分子 | |
| C. | 一定量的浓H2SO4与0.1molMg恰好完全反应,生成SO2为0.1NA | |
| D. | 标准状况下,22.4L由SO2和O3组成的混合气体中含有3NA个原子 |
| A. | 标准状况下,11.2 L气体氘气(D2)中含有0.5NA个中子 | |
| B. | 1 L 0.1 mol•L-1醋酸溶液中含有0.1NA个氢离子 | |
| C. | 电解精炼铜时,若电路中转移0.2NA个电子,则阳极质量一定减少6.4 g | |
| D. | NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为NA个 |
| A. | 若管道漏气则遇氨就会产生白烟 | |
| B. | 该反应利用了Cl2的强氧化性 | |
| C. | 实验室可用 NH4Cl受热分解制取NH3 | |
| D. | 生成1 molN2有6 mol电子转移 |
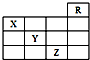
 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )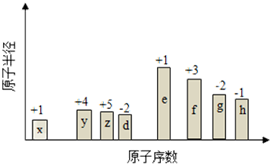 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: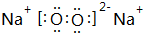 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.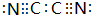 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.