题目内容
3.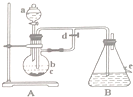 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:(1)仪器a的名称为分液漏斗,实验时由a向烧瓶中加硫酸至b(填“b”或“c”)
(2)为了能较长时间看到Fe(OH)2白色沉淀,关于活塞d,正确的操作为②(填编号)
①实验开始时应先将关闭d,一段时间后再打开 ②实验开始时应先将打开d,一段时间后再关闭
(3)在B中观察到白色沉淀后,打开e,现象为白色沉淀变为灰绿色,最后变为红褐色反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 (1)根据仪器a的构造可知其名称为分液漏斗;实验时由a向烧瓶中加硫酸,使导管浸入溶液中;
(2)为了能较长时间看到Fe(OH)2白色沉淀,应该先用氢气排出装置中氧气,即先打开d,然后关闭d,利用生成氢气产生的压强将硫酸亚铁溶液压入B中生成氢氧化亚铁;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.
解答 解:(1)根据图示可知,仪器a为分液漏斗;为了使生成的硫酸亚铁溶液压入装置B中,实验时由a向烧瓶中加硫酸至b,使导管浸入溶液中
故答案为:分液漏斗;b;
(2)为了能较长时间看到Fe(OH)2白色沉淀,必须保证装置中没有氧气,故应该先用铁与稀硫酸反应生成的氢气排出装置中氧气,所以先打开d;然后关闭d,利用生成的氢气增大A装置中压强,将硫酸亚铁溶液压入B中生成氢氧化亚铁,所以操作②正确,
故答案为:②;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀变为灰绿色,最后变为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了氢氧化亚铁的制备方法,题目难度中等,明确实验目的及原理为解答关键,注意掌握制备氢氧化亚铁的方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
13.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
18.下列各离子方程式中,属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
15.下列除去杂质的方法正确的是物质杂质试剂主要操作( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Fe2O3 | SiO2 | NaOH | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |