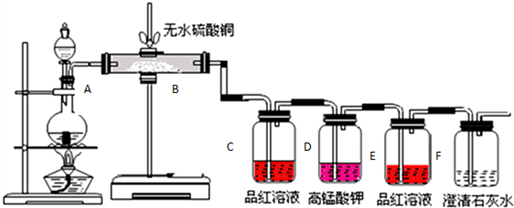
题目内容
7.研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)?2NO2(g)的反应历程分两步:①2NO(g)?N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0
②N2O2(g)+O2(g)?2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)△H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)?2NO2(g)的△H=kJ•mol-1(用含△H△H1+△H21和△H2的式子表示).一定温度下,反应2NO(g)+O2(g)?2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=$\frac{{k}_{1正}•{k}_{2正}}{{k}_{1逆}•{k}_{2逆}}$,升高温度,K值减小(填“增大”、“减小”或“不变”).
(2)决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1<E2(填“>”、“<”或“=”).根据速率方程分析,升高温度该反应速率减小的原因是c.
a.k2正增大,c(N2O2)增大b.k2正减小,c(N2O2)减小
c.k2正增大,c(N2O2)减小d.k2正减小,c(N2O2)增大
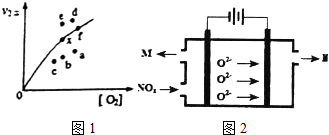
由实验数据得到v2正~[O2]的关系可用如图1表示.当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为a(填字母).
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3•H2O=NH4NO3+NH4NO2+H2O.若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+)<c(NO3-)+c(NO2-)(填“>”“<”或“=”).工业上也可用电解法处理氮氧化物的污染.电解池如图2所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-.该电解池阴极的电极反应式是2NOx+4xe-=N2+2xO2-.阳极产生的气体N的化学式是O2.
分析 (1)①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})×c({O}_{2})}$,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小,由此分析解答;
(2)因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,由此分析解答;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),O2-在阳极发生氧化反应,而氮的氧化物在阴极发生还原反应,由此分析解答.
解答 解:(1))①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})×c({O}_{2})}$=$\frac{{k}_{1正}•{k}_{2正}}{{k}_{1逆}•{k}_{2逆}}$,而正反应是放热反应,所以升高温度,平衡常数减小,故答案为:△H1+△H2;$\frac{{k}_{1正}•{k}_{2正}}{{k}_{1逆}•{k}_{2逆}}$;减小;
(2)因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;c;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,故答案为:<;2NOx+4xe-=N2+2xO2-;O2.
点评 本题考查了盖斯定律的应用、化学平衡的影响因素,电解质溶液和电极反应式的书写,题目综合性较强,难度中等,侧重于考查学生的分析能力、以及对基础知识的综合应用能力.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(2)写出E单质与NaOH溶液反应的离子方程式2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)1g B2A4完全燃烧,恢复到常温时放出a kJ的热量,写出B2A4完全燃烧的热化学方程式C2H4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-28a kJ/mol;B2A4形成高分子的化学方程式n C2H4$\stackrel{一定条件}{→}$
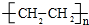 .
.(4)RT4极易水解生成两种酸,写出该反应的化学方程式SiCl4+4H2O=H4SiO4↓+4HCl.
(5)工业上用A元素的单质、C元素的单质合成化合物,此反应的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}(N{H}_{3})}$;为了提高合成效率,常采用的方法有采取高温高压、使用催化剂.
(6)D的过氧化物的电子式为
 ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.(7)工业上电解饱和DT水溶液的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 11.7 |
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
| A. | A2>B2>C2>D2 | B. | D2>C2>B2>A2 | C. | B2>C2>A2>D2 | D. | C2>A2>B2>D2 |
 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.