题目内容
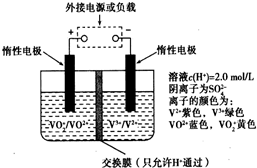 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该电池放电时,右槽中的电极反应为:V2+-e-=V3+,为被氧化的过程,应为原电池负极反应,则左槽为原电池正极,发生还原反应,电极方程式应为VO2++2H++e-=VO2++H2O,充电时电极反应为放电电极反应的逆反应,以此解答该题.
解答:
解:A.充电时,左侧电极为阳极,发生氧化反应,电极方程式为VO2++H2O-e-=VO2++2H+,pH减小,故A错误;
B.放电时,该装置为原电池,左槽作正极,右槽作负极,氢离子通过交换膜定向移入左槽,故B正确;
C.电池放电时,右槽为负极,电极反应为:V2+-e-=V3+,溶液颜色由紫色变为绿色,故C正确;
D.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,当转移电子为3.01×1024个即为5mol电子时,生成氢离子为10mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过5mol电子,则左槽溶液中n(H+)的变化量为10mol-5mol=5mol,故D正确.
故选A.
B.放电时,该装置为原电池,左槽作正极,右槽作负极,氢离子通过交换膜定向移入左槽,故B正确;
C.电池放电时,右槽为负极,电极反应为:V2+-e-=V3+,溶液颜色由紫色变为绿色,故C正确;
D.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,当转移电子为3.01×1024个即为5mol电子时,生成氢离子为10mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过5mol电子,则左槽溶液中n(H+)的变化量为10mol-5mol=5mol,故D正确.
故选A.
点评:本题考查了原电池和电解池,会根据得失电子判断原电池正负极和电解池阴阳极,知道充电电池中原电池正负极发生的电极反应式是电解池阳极、阴极电极反应式的逆反应,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是( )
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A、绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应 |
| B、天宫一号使用的碳纤维是一种新型有机高分子材料 |
| C、顺丁橡胶、腈纶、涤纶和“人造棉花”都属于合成纤维 |
| D、因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂 |
下列说法一定正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C、将FeCl3溶液加热蒸干,可得到FeCl3固体 |
| D、0.10mol/L Al2(SO4)3溶液中Al3+数小于0.2NA(NA代表阿伏加德罗常数) |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,15g甲基(-14CH3)所含的电子数为9NA |
| B、常温下,2L pH=12的Na2CO3溶液中含有的OH-数目为0.02NA |
| C、6.8g液态KHSO4中含有0.1NA个阳离子 |
| D、1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):