题目内容
如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由图可知,为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,结合对应物质的性质解答该题.
解答:
解:由图可知,为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,
A.F元素没有最高价含氧酸,故A错误;
B.O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,故B正确;
C.二氧化硅能与氢氟酸反应生成四氟化硅与水,故C错误;
D.Na与氯化铝溶液反应,首先钠与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铝反应,不能置换出Al单质,故D正确,
故选BD.
A.F元素没有最高价含氧酸,故A错误;
B.O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,故B正确;
C.二氧化硅能与氢氟酸反应生成四氟化硅与水,故C错误;
D.Na与氯化铝溶液反应,首先钠与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铝反应,不能置换出Al单质,故D正确,
故选BD.
点评:本题考查原子结构与元素周期律,难度不大,注意根据原子半径的递变规律判断元素的种类为解答该题的关键.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
关于各组溶液中微粒浓度的关系正确的是( )
| A、等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、将一定量氨气通入0.1mol?L-1 NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、向CH3COONa溶液中滴加稀盐酸至中性时有:c(Cl-)>c(Na+)>c(CH3COOH) |
| D、等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
不能用金属跟盐酸反应直接得到的盐是( )
| A、AlCl3 |
| B、FeCl3 |
| C、MgCl2 |
| D、ZnCl2 |
分类法是人们认识事物时常用的科学方法.下列关于“Na2CO3”分类的说法错误的是( )
| A、属于钠盐 |
| B、属于电解质 |
| C、属于离子化合物 |
| D、属于氧化物 |
 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |
据图判断下列说法正确的是( )


| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:b点的比a点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调pH约为4左右 |
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
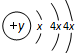
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.