题目内容
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):(1)元素B、C的第一电离能的大小关系是
(2)A的某种氢化物A2H2分子的空间构型是
(3)写出E原子的核外电子排布式是
(4)由E元素形成的金属的晶胞结构如图,已知该晶胞边长为a厘米,该晶体的密度为
(5)配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于
考点:位置结构性质的相互关系应用,判断简单分子或离子的构型,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A元素最外层电子数是内层电子数的2倍,原子只能有2的电子层,最外层电子数为4,则A为碳元素,A、B、C是同一周期的非金属元素,B元素基态原子的最外层有3个未成对电子,外围电子排布为2s22p3,则B为氮元素;化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,则化合物DC中C为-2价,可推知C为O元素,故D为Mg;E元素的正三价离子的3d亚层为半充满状态,则E原子核外电子数=2+8+13+3=26,则E为Fe,据此解答.
解答:
解:A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A元素最外层电子数是内层电子数的2倍,原子只能有2的电子层,最外层电子数为4,则A为碳元素,A、B、C是同一周期的非金属元素,B元素基态原子的最外层有3个未成对电子,外围电子排布为2s22p3,则B为氮元素;化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,则化合物DC中C为-2价,可推知C为O元素,故D为Mg;E元素的正三价离子的3d亚层为半充满状态,则E原子核外电子数=2+8+13+3=26,则E为Fe,
(1)N、O同周期,氮元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,原子失去一个电子较难,第一电离能N>O,
故答案为:N>O;氮原子2p轨道容纳3个电子,为半满稳定状态,能量较低,原子失去一个电子较难;
(2)C2H2分子的空间构型是直线型,其中心C原子没有孤电子对、成2个σ键,C原子采取的杂化形式为sp,分子中含有3个σ键,2个π键,
故答案为:直线型;sp;3;2;
(3)E为Fe元素,原子核外有26个电子,核外电子排布式是[Ar]3d64s2 ;
用电子式表示化合物MgO的形成过程为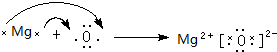 ,
,
故答案为:[Ar]3d64s2 ; ;
;
(4)晶胞中Fe原子数目=1+8×
=2,晶胞质量=2×
g,该晶胞边长为a厘米,晶胞体积=a3cm3,该晶体的密度为
=
g/cm3,
故答案为:
g/cm3;
(5)配合物Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,据此判断Fe(CO)5晶体属于分子晶体,
故答案为:分子晶体.
(1)N、O同周期,氮元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,原子失去一个电子较难,第一电离能N>O,
故答案为:N>O;氮原子2p轨道容纳3个电子,为半满稳定状态,能量较低,原子失去一个电子较难;
(2)C2H2分子的空间构型是直线型,其中心C原子没有孤电子对、成2个σ键,C原子采取的杂化形式为sp,分子中含有3个σ键,2个π键,
故答案为:直线型;sp;3;2;
(3)E为Fe元素,原子核外有26个电子,核外电子排布式是[Ar]3d64s2 ;
用电子式表示化合物MgO的形成过程为
 ,
,故答案为:[Ar]3d64s2 ;
 ;
;(4)晶胞中Fe原子数目=1+8×
| 1 |
| 8 |
| 56 |
| NA |
2×
| ||
| a3cm3 |
| 112 |
| a3NA |
故答案为:
| 112 |
| a3NA |
(5)配合物Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,据此判断Fe(CO)5晶体属于分子晶体,
故答案为:分子晶体.
点评:本题是对物质结构的考查,涉及核外电子排布、电离能、分子结构、化学键、电子式、晶胞计算、晶体类型与性质等,需要学生具备扎实的基础,注意掌握电子式表示化学键或物质的形成过程,难得中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列的离子方程式中,书写正确的一项是( )
| A、氨水中通入过量CO2:2NH3?H2O+CO2═2NH4++CO32-+H2O |
| B、稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| C、钠与水反应Na+2H2O═Na++2OH-+H2↑ |
| D、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |
下列有关实验的表述中,错误的是( )
| A、除去乙醇的水:加新制生石灰,蒸馏,收集馏出物 |
| B、检验淀粉的水解产物:在用酸作催化剂的水解液中直接加入新制Cu(OH)2溶液,然后加热,观察是否有红色沉淀生成 |
| C、除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| D、银氨溶液的配制:在洁净的试管中加2% AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止 |
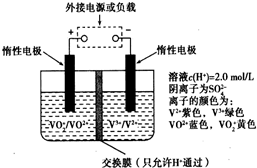 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |

 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题: