题目内容
下列说法一定正确的是( )
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C、将FeCl3溶液加热蒸干,可得到FeCl3固体 |
| D、0.10mol/L Al2(SO4)3溶液中Al3+数小于0.2NA(NA代表阿伏加德罗常数) |
考点:化学反应速率的影响因素,化学平衡的影响因素,盐类水解的应用
专题:化学反应速率专题,盐类的水解专题
分析:A、使用催化剂能同等程度的增大正逆反应速率,据此分析解答;
B、升高温度、使用催化剂能增大反应速率,据此分析解答;
C、根据溶液中铁离子的水解以及水解是吸热的过程来回答判断;
D、硫酸铝溶液中铝离子会发生水解,且N=nNA=cVNA.
B、升高温度、使用催化剂能增大反应速率,据此分析解答;
C、根据溶液中铁离子的水解以及水解是吸热的过程来回答判断;
D、硫酸铝溶液中铝离子会发生水解,且N=nNA=cVNA.
解答:
解:A、使用催化剂能加快反应速率,但是不会引起平衡的移动,所以不能提高反应物的平衡转化率,故A错误;
B、对于反应2H2O2═2H2O+O2↑,加入催化剂MnO2或升高温度都能加快化学反应生成氧气的速率,故B正确;
C、将FeCl3溶液加热蒸干,可得到Fe(OH)3固体,故C错误;
D、溶液的体积不知道,所以不能计算铝离子的物质的量,无法计算微粒数目,故D错误.
故选B.
B、对于反应2H2O2═2H2O+O2↑,加入催化剂MnO2或升高温度都能加快化学反应生成氧气的速率,故B正确;
C、将FeCl3溶液加热蒸干,可得到Fe(OH)3固体,故C错误;
D、溶液的体积不知道,所以不能计算铝离子的物质的量,无法计算微粒数目,故D错误.
故选B.
点评:本题涉及影响化学反应速率的因素、盐的水解以及溶液中微粒数的计算等方面知识,属于基本知识的考查,较简单.

练习册系列答案
相关题目
不能用金属跟盐酸反应直接得到的盐是( )
| A、AlCl3 |
| B、FeCl3 |
| C、MgCl2 |
| D、ZnCl2 |
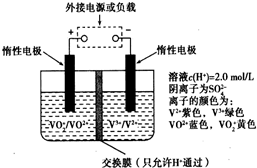 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |
据图判断下列说法正确的是( )


| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:b点的比a点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调pH约为4左右 |
向一定量的Fe、FeO、Fe2O3的混合物中,加入200mL 2mol/L的盐酸,恰好完全反应并放出标准状况下224mL气体;向所得溶液中加入KSCN溶液后无血红色出现,则所得溶液中Fe2+的物质的量浓度为(假设反应后溶液体积仍为200mL)( )
| A、0.5mol?L-1 |
| B、1 mol?L-1 |
| C、2mol?L-1 |
| D、0.1mol?L-1 |
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
