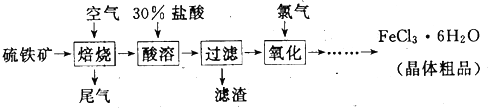
题目内容
 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:(1)该浓硫酸中H2SO4的物质的量浓度为
(2)取用任意体积的该浓硫酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液的密度
B.溶液中H2SO4的物质的量
C.溶液的浓度
D.溶液中SO42-的数目
(3)实验室现只有下列几种规格的容量瓶:100mL、200mL、250mL、500mL.某学生欲用上述浓硫酸和蒸馏水配制180mL物质的量浓度为0.46mol?L-1的稀硫酸.
①容量瓶上需标有以下五项中的
A.温度 B.刻度线 C.容量 D.压强 E.浓度
②将下列操作填写完整,并排列其正确的操作顺序(用字母编号表示,每个字母只能用一次)
A.改用
B.盖好容量瓶的瓶塞,上下颠倒摇匀
C.往容量瓶内小心加水,直到液面接近刻度线1~2cm处
D.用30mL水洗涤烧杯和玻璃棒2~3次,将每次洗涤液都注入到容量瓶中,轻轻振荡
E.将已冷却的硫酸沿玻璃棒慢慢注入到容量瓶中
F.用量筒准确量取浓硫酸
③在配制过程中,下列实验操作对所配制稀硫酸的物质的量浓度有何影响?(在横线上填“偏高”、“偏低”、“无影响”).
Ⅰ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅱ.定容时仰视刻度线
Ⅲ.溶液注入容量瓶前没有冷却到室温
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)浓硫酸的物质的量浓度为c=
计算浓硫酸的浓度;
(2)溶液是均一、稳定的,其浓度、密度等与溶液体积无关;
(3)①根据容量瓶的结构来分析;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
A、定容时,应用胶头滴管来逐滴加入水;
F、根据溶液稀释定律C浓V浓=C稀V稀来计算所需浓硫酸的体积;
③根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
| 1000ρω |
| M |
(2)溶液是均一、稳定的,其浓度、密度等与溶液体积无关;
(3)①根据容量瓶的结构来分析;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
A、定容时,应用胶头滴管来逐滴加入水;
F、根据溶液稀释定律C浓V浓=C稀V稀来计算所需浓硫酸的体积;
③根据c=
| n |
| V |
解答:
解:(1)浓硫酸的物质的量浓度为c=
=
=18.4mol/L,故答案为:18.4;
(2)溶液是均一、稳定的,其浓度、密度等与溶液体积无关,故答案为:AC;
(3)①容量瓶只有一条刻度线,瓶体上标有容量和温度,故答案为:ABC;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是FEDCAB;
A、定容时,应用胶头滴管来逐滴加水至凹液面与刻度线相切;
F、由于无180mL容量瓶,故选用200mL容量瓶,故配制出的溶液是250mL0.46mol/L的硫酸,设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:0.46mol/L×200mL=18.4mol/L×VmL
解得V=5.0mL,
故答案为:FEDCAB;胶头滴管;5.0;
③Ⅰ.定容后经振荡、摇匀、静置,发现液面下降是正常的,再加适量的蒸馏水则浓度偏低,故答案为:偏低;
Ⅱ.定容时仰视刻度线,会导致溶液体积偏大,则浓度偏低,故答案为:偏低;
Ⅲ.溶液注入容量瓶前没有冷却到室温,则冷却后溶液体积偏小,则浓度偏高,故答案为:偏高.
| 1000ρω |
| M |
| 1000×1.84g/mol×98% |
| 98g/mol |
(2)溶液是均一、稳定的,其浓度、密度等与溶液体积无关,故答案为:AC;
(3)①容量瓶只有一条刻度线,瓶体上标有容量和温度,故答案为:ABC;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是FEDCAB;
A、定容时,应用胶头滴管来逐滴加水至凹液面与刻度线相切;
F、由于无180mL容量瓶,故选用200mL容量瓶,故配制出的溶液是250mL0.46mol/L的硫酸,设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:0.46mol/L×200mL=18.4mol/L×VmL
解得V=5.0mL,
故答案为:FEDCAB;胶头滴管;5.0;
③Ⅰ.定容后经振荡、摇匀、静置,发现液面下降是正常的,再加适量的蒸馏水则浓度偏低,故答案为:偏低;
Ⅱ.定容时仰视刻度线,会导致溶液体积偏大,则浓度偏低,故答案为:偏低;
Ⅲ.溶液注入容量瓶前没有冷却到室温,则冷却后溶液体积偏小,则浓度偏高,故答案为:偏高.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
下列有关实验的说法正确的是( )
| A、除去铁粉中混有少量铝粉,可加入过量的稀硫酸溶液,完全反应后过滤 |
| B、为测定熔融氢氧化钠的导电性,不能在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C、制备Fe(OH)3胶体,通常是将NaOH溶液滴入FeCl3溶液中 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
下列叙述正确的是( )
| A、pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同 | ||
B、室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中
| ||
| C、醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH | ||
D、在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3?H2O的电离常数Kb=
|