题目内容
下列有关实验的说法正确的是( )
| A、除去铁粉中混有少量铝粉,可加入过量的稀硫酸溶液,完全反应后过滤 |
| B、为测定熔融氢氧化钠的导电性,不能在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C、制备Fe(OH)3胶体,通常是将NaOH溶液滴入FeCl3溶液中 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
考点:化学实验方案的评价,电解质溶液的导电性,物质的分离、提纯的基本方法选择与应用,常见阴离子的检验
专题:实验评价题
分析:A.铁、铝都与稀硫酸反应;
B.高温下,氢氧化钠与二氧化硅反应;
C.将NaOH溶液滴入FeCl3溶液中得到氢氧化铁沉淀,不能得到胶体;
D.使澄清石灰水变浑浊的气体可能为二氧化碳或二氧化硫.
B.高温下,氢氧化钠与二氧化硅反应;
C.将NaOH溶液滴入FeCl3溶液中得到氢氧化铁沉淀,不能得到胶体;
D.使澄清石灰水变浑浊的气体可能为二氧化碳或二氧化硫.
解答:
解:A.铁、铝都与稀硫酸反应,应加入氢氧化钠溶液除杂,故A错误;
B.高温下,氢氧化钠与二氧化硅反应,可使坩埚炸裂,故B正确;
C.制备Fe(OH)3胶体,应将饱和氯化铁溶液滴加到沸水中,至溶液呈红褐色停止加热,将NaOH溶液滴入FeCl3溶液中得到氢氧化铁沉淀,不能得到胶体,故C错误;
D.使澄清石灰水变浑浊的气体可能为二氧化碳或二氧化硫,不一定为CO32-,故D错误.
故选B.
B.高温下,氢氧化钠与二氧化硅反应,可使坩埚炸裂,故B正确;
C.制备Fe(OH)3胶体,应将饱和氯化铁溶液滴加到沸水中,至溶液呈红褐色停止加热,将NaOH溶液滴入FeCl3溶液中得到氢氧化铁沉淀,不能得到胶体,故C错误;
D.使澄清石灰水变浑浊的气体可能为二氧化碳或二氧化硫,不一定为CO32-,故D错误.
故选B.
点评:本题考查较为综合,涉及物质的分离、检验以及较为的制备等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
下列装置所示的实验中,能达到实验目的是( )
A、 除去Cl2中的HCl |
B、 防止地下钢管腐蚀 |
C、 分离酒精和水 |
D、 电解精炼铜 |
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终消耗的硝酸的物质的量是( )
| A、12 mo1 |
| B、15 mo1 |
| C、16 mo1 |
| D、17 mo1 |
下列物质属于电解质的是( )
| A、NaCl溶液 | B、油脂 |
| C、NaClO | D、Cu |
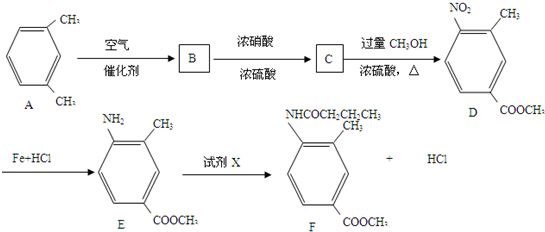
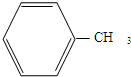 制备化合物
制备化合物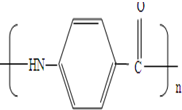
 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题: 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )