题目内容
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)D元素在周期表中的位置是 .
(2)B、C、D元素原子半径由大到小的顺序是 (用元素符号表示).
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 .
(4)单质E与水反应的离子方程式为 .
(5)下列选项中能作为判断B和D的非金属性强弱的依据有(填字母编号) .
a.B和D的单质的熔点高低
b.B和D的氢化物的稳定性强弱
c.B和D的单质与氧气反应的难易
d.B和D的最高价氧化物对应的水化物的酸性强弱.
(1)D元素在周期表中的位置是
(2)B、C、D元素原子半径由大到小的顺序是
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为
(4)单质E与水反应的离子方程式为
(5)下列选项中能作为判断B和D的非金属性强弱的依据有(填字母编号)
a.B和D的单质的熔点高低
b.B和D的氢化物的稳定性强弱
c.B和D的单质与氧气反应的难易
d.B和D的最高价氧化物对应的水化物的酸性强弱.
考点:位置结构性质的相互关系应用
专题:
分析:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D同族,则D为磷元素;C和E形成的化合物在水中呈中性,则E为Cl元素,验证符合,据此解答各小题即可.
解答:
解:依据分析可知:A为氢,B为氮,C为钠,D为磷,E为氯,
(1)D元素为P,处于周期表中第三周期第ⅤA族,故答案为:第三周期第ⅤA族;
(2)N、Na、P元素原子半径,同一周期中,原子序数越小,半径越大,周期数越大,半径越大,故N、Na、P的原子半径由大到小的顺序是:Na>P>N,
故答案为:Na>P>N;
(3)H和Cl形成的化合物为HCl,H和N形成的化合物为氨气,两者反应生成氯化铵,产物的化学式为NH4Cl,故答案为:NH4Cl;
(4)单质E为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(5)a.N和P的单质的熔点高低与其非金属性无关,故a错误;
b.N和P的氢化物的稳定性强弱可以比较N与P的非金属性强弱,氢化物越稳定,非金属性越强,故b正确;
c.N和P的单质与氧气反应的难易,不能证明非金属性强弱,故c错误;
d.N和P的最高价氧化物对应的水化物的酸性强弱可以比较,酸性越强,非金属性越强,故d正确,故选bd.
(1)D元素为P,处于周期表中第三周期第ⅤA族,故答案为:第三周期第ⅤA族;
(2)N、Na、P元素原子半径,同一周期中,原子序数越小,半径越大,周期数越大,半径越大,故N、Na、P的原子半径由大到小的顺序是:Na>P>N,
故答案为:Na>P>N;
(3)H和Cl形成的化合物为HCl,H和N形成的化合物为氨气,两者反应生成氯化铵,产物的化学式为NH4Cl,故答案为:NH4Cl;
(4)单质E为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(5)a.N和P的单质的熔点高低与其非金属性无关,故a错误;
b.N和P的氢化物的稳定性强弱可以比较N与P的非金属性强弱,氢化物越稳定,非金属性越强,故b正确;
c.N和P的单质与氧气反应的难易,不能证明非金属性强弱,故c错误;
d.N和P的最高价氧化物对应的水化物的酸性强弱可以比较,酸性越强,非金属性越强,故d正确,故选bd.
点评:本题考查位置结构性质关系、常用化学用语、元素周期律,难度中等,推断元素是解题的关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为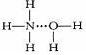 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |
某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下处理(假设每次处理均反应完全):①通过碱石灰,气体体积减小;②通过灼热的氧化铜时,固体变为红色;③通过无水CuSO4粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变为浑浊.由此可以确定混合气体中( )
| A、一定含有CO2、H2O蒸气,可能含有H2、CO |
| B、一定含有H2O蒸气、CO,可能含有CO2、H2 |
| C、一定含有CO2、CO,可能含有H2O蒸气、H2 |
| D、一定含有CO、H2,可能含有H2O蒸气、CO2中的1种或2种 |
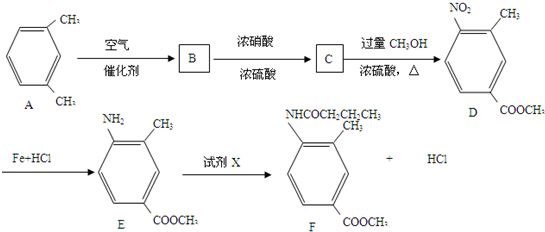
 制备化合物
制备化合物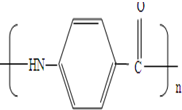
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置. 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题: