题目内容
9.某兴趣小组同学用以下甲、乙、丙三套装置(夹持和加热仪器已略去)来测定铜元素的相对原子质量,同时检验氧化性.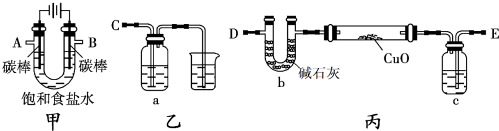
(1)为完成上述实验,正确的连接顺序为E连接A,C连接B(填字母)
(2)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作是检验氢气的纯度,原因是氢气不纯加热易引起爆炸
(3)乙装置的a瓶中溶液可以是淀粉碘化钾溶液,实验过程中观察到的对应现象为溶液变为蓝色.
(4)丙装置的c瓶中盛放的试剂为浓硫酸,作用是吸收氢气中的水,防止硬质玻璃管炸裂.
(5)为测定Cu 的相对原子质量,设计了如下两个实验方案,精确测量硬质玻璃管的质量为ag,放入CuO后,精确测量硬质玻璃管和CuO的总质量为bg,实验完毕后:
方案Ⅰ:通过精确测量硬质玻璃管和Cu粉的总质量(cg)来确定Cu的相对原子质量.
方案Ⅱ:通过精确测量生成水的质量(dg)来确定Cu的相对原子质量.
①方案Ⅰ所测结果更准确,不合理的方案的不足之处是空气中的二氧化碳和水通过D口进入U形管造成实验误差较大;.
②若按方案Ⅰ测量的数据计算,Cu的相对原子质量为$\frac{16(c-a)}{b-c}$.
分析 (1)依据装置图分析可知,电解饱和食盐水阳极B是氯离子失电子发生氧化反应生成氯气,阴极A是氢离子得到电子发生还原反应,生成氢气,电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性,装置丙中的E接电解装置中的A;装置乙是验证氯气氧化性的装置,D接电解池的B电极;
(2)加热氧化铜之前要检验纯度,否则加热易引起爆炸;
(3)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝;
(4)电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,必须干燥;
(5)选用了方案Ⅰ数据进行计算是利用反应前后CuO中氧元素的减少量和实验前准确称取CuO的质量为wg中氧元素的质量相等,求得Cu的相对原子质量;
选方案Ⅱ的数据进行计算时,主要考虑U型管也可能吸收空气中的CO2这方面原因会导致测定Cu的相对原子质量有偏差.
解答 解:(1)装置图分析可知,电解饱和食盐水阳极B是氯离子失电子发生氧化反应生成氯气,阴极A是氢离子得到电子发生还原反应,生成氢气,电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性,装置丙中的E接电解装置中的A;装置乙是验证氯气氧化性的装置,C接电解池的B电极,故答案为:A;B;
(2)加热氧化铜之前要检验纯度,否则加热易引起爆炸,故答案为:检验氢气的纯度;氢气不纯加热易引起爆炸;
(3)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝,可以用湿润的淀粉碘化钾试纸来检验,故答案为:淀粉碘化钾溶液;溶液变为蓝色;
(4)氢气的干燥可以用浓硫酸,在实验时,如果氢气中有水,会将硬质玻璃管炸裂,故答案为:浓硫酸;吸收氢气中的水,防止硬质玻璃管炸裂;
(5)①选方案Ⅱ的数据进行计算时,U型管也可能吸收空气中的CO2这方面原因会导致测定Cu的相对原子质量有误差,所以方案Ⅰ更准确,故答案为:Ⅰ;空气中的二氧化碳和水通过D口进入U形管造成实验误差较大;
②根据Ⅰ方案,设金属铜的原子量为M,则
CuO~Cu
M+16 M
b-a c-a
$\frac{M+16}{b-a}$=$\frac{M}{c-a}$,解得M=$\frac{16(c-a)}{b-c}$,故答案为:$\frac{16(c-a)}{b-c}$.
点评 本题考查学生对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.

| A. | 1:10 | B. | 9:1 | C. | 1:9 | D. | 99:21 |
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的硫酸钠固体,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性增强 |
| A. | D的浓度减小了 | B. | A的转化率减小了 | ||
| C. | 物质B的质量分数增加了 | D. | a+b>c+d |
| A. | 7 种 | B. | 6 种 | C. | 5 种 | D. | 4 种 |
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
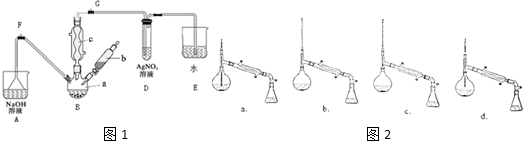
请分析后回答下列问题.
(1)打开G处止水夹,关闭F处止水夹,在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,继续滴加至液溴滴完,三颈烧瓶中发生反应的化学方程式为
 .
.(2)液溴滴完后,打开F处止水夹,关闭G处止水夹,一段时间后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的Fe;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,再经过分液,(填实验操作名称)分离出的粗溴苯,再中加入少量的无水氯化钙,静置、过滤.
(3)经以上分离操作后,要把粗溴苯进一步提纯,进行的实验操作中,仪器选择及安装都正确的是如图2:b(填字母)锥形瓶中得到的主要物质是苯(填物质名称).
(4)D中试管内出现的现象是溶液中有淡黄色沉淀生成,某同学认为不能因此证明苯和液溴的反应是取代反应,若要证明,需改进的实验操作是在B、D间安装一个装有CCl4溶液的洗气瓶.
(5)本实验存在一个明显不足之处是制溴苯过程中装置D、E中的溶液容易倒吸入装置B,导致实验失败.
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |