题目内容
20.己知热化学方程式如下:CaSO4(s)+CO (g)?CaO(s)+SO2(g)+CO2(g)△H 1=+218.4kJ/mol (反应I)
CaSO4 (s)+4CO (g)?CaS (s)+4CO2(g)△H2=-175.6kJ/mol(反应II)
假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是( )
| A. |  | B. | 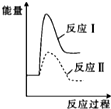 | C. | 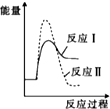 | D. | 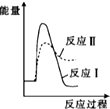 |
分析 反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断.
解答 解;反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误,因为两图中生成物总能量高于反应物总能量,由题意知:反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、C正确,故选C.
点评 本题涉及化学平衡以及反应热与焓变的考查,主要是反应物和生成物能量的比较,来判断反应吸热还是放热反应,反应能量变化和起始和终了物质有关和变化过程无关,题目难度中等.

练习册系列答案
相关题目
8.下列化学式只能表示一种物质的是( )
| A. | C3H6 | B. | C2H6O | C. | C6H6 | D. | CH2Cl2 |
15. A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:H-C≡C-H.
(2)写出E元素的元素符号:Co,其价电子排布图为: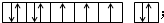 .
.
(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
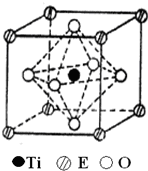
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:Co,其价电子排布图为:
 .
.(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
5.下列关于价电子构型为4s24p4的基态原子描述正确的是( )
| A. | 它的元素名称为锡 | B. | 它的核外电子排布式为[Ar]4s24p4 | ||
| C. | 它的第一电离能小于As | D. | 其外围电子排布图为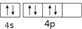 |
10.下列元素中,化学性质最活泼的是( )
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 氯 |

 .
. .
. .
.