题目内容
5.下列关于价电子构型为4s24p4的基态原子描述正确的是( )| A. | 它的元素名称为锡 | B. | 它的核外电子排布式为[Ar]4s24p4 | ||
| C. | 它的第一电离能小于As | D. | 其外围电子排布图为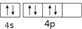 |
分析 A.价电子构型为4s24p4的元素是34号元素Se;
B.电子排布式为1s22s22p63s23p63d104s24p4;
C.同周期元素第VA族的第一电离能大于第VIA族;
D.4p能级上电子排布图违反洪特规则.
解答 解:A.价电子构型为4s24p4的元素是34号元素Se,其名称为硒,故A错误;
B. Se元素的核外有34个电子,其电子排布式为1s22s22p63s23p63d104s24p4,故B错误;
C.同周期元素第VA族的第一电离能大于第VIA族,所以Se的第一电离能小于As,故C正确;
D.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以4p能级上电子排布图违反洪特规则,故D错误.
故选C.
点评 本题考查原子核外电子排布,明确构造原理、洪特规则等知识点是解本题关键,难度不大,侧重于考查学生对基本原理的应用能力.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
15.某有机化合物的结构简式如图,对该有机化合物说法错误的是( )
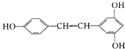

| A. | 是苯酚的同系物 | B. | 可发生加成、氧化、取代等反应 | ||
| C. | 所有原子可能共平面 | D. | 分子式为C14H12O3 |
16.下列晶体或分子中,含有化学键类型有差异的一组是( )
| A. | NH3、NO2 | B. | NaCl、KF | C. | NaOH、Ca(OH)2 | D. | MgO、H2O2 |
13.通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A. | NCl3和SiO32-的中心原子的杂化方式相同,都是sp3杂化 | |
| B. | 分子构型为平面三角形 | |
| C. | NCl3比NBr3易挥发 | |
| D. | NC13是极性键构成的非极性分子 |
17.质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为( )
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A}$(A-N+6)mol |
14.下列说法正确的是( )
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
15.A、B、C、D四种原子序数依次增大的元素,分布在三个不同的短周期,其中B与C为同一周期的相邻元素,A与D为同一主族.C原子的最外层电子数是次外层电子数的3倍,D是所在周期原子半径最大的元素.下列说法正确的是( )
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |